Хром — Википедия
| Хром | |
|---|---|
| ← Ванадий | Марганец → | |
| Твёрдый металл голубовато-белого цвета | |
 | |
| Название, символ, номер | Хром / Chromium (Cr), 24 |
| Атомная масса (молярная масса) | 51,9961(6)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Радиус атома | 130 пм |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Электродный потенциал | −0,74 |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 652,4 (6,76) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,19 г/см³ |
| Температура плавления | 2130 K (1856,9 °C) |
| Температура кипения | 2945 K (2671,9 °C) |
| Уд. теплота плавления | 21 кДж/моль |
| Уд. теплота испарения | 342 кДж/моль |
| Молярная теплоёмкость | 23,3[2] Дж/(K·моль) |
| Молярный объём | 7,23 см³/моль |
| Структура решётки | кубическая |
| Параметры решётки | 2,885 Å |
| Температура Дебая | 460 K |
| Теплопроводность | (300 K) 93,9 Вт/(м·К) |
| Номер CAS | 7440-47-3 |
Хром — элемент 6-й группы (по устаревшей классификации — побочной подгруппы 6-й группы) 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром — твёрдый металл голубовато-белого цвета. Хром иногда относят к чёрным металлам.
Происхождение названия[править | править код]
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История[править | править код]
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл ( Воклен получил карбид хрома). Он прокалил зелёный оксид Cr2O3 с углём и выделил тугоплавкий металл (с примесью карбидов). Сам оксид Cr2O3 Воклен получил разложением «Сибирского красного свинца» — минерала крокоита PbCrO4.
Современный способ получения чистого хрома (с 1894 г.) отличается от способа Воклена только видом восстановителя. Процесс электролитического покрытия железа хромом разработан в 20-х годах ХХ в.
Хром является довольно распространённым элементом в земной коре (0,03 % по массе)[3]. Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения[править | править код]
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении[4], Бразилии, на Филиппинах[5].
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире)[5].
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- V2O5 до 0,2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.
Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
- Fe(CrO2)2+4C→Fe+2Cr+4CO{\displaystyle {\mathsf {Fe(CrO_{2})_{2}+4C\rightarrow Fe+2Cr+4CO}}}
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
- 4Fe(CrO2)2+8Na2CO3+7O2→8Na2CrO4+2Fe2O3+8CO2{\displaystyle {\mathsf {4Fe(CrO_{2})_{2}+8Na_{2}CO_{3}+7O_{2}\rightarrow 8Na_{2}CrO_{4}+2Fe_{2}O_{3}+8CO_{2}}}}
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
- Na2Cr2O7+2C→Cr2O3+Na2CO3+CO{\displaystyle {\mathsf {Na_{2}Cr_{2}O_{7}+2C\rightarrow Cr_{2}O_{3}+Na_{2}CO_{3}+CO}}}
5) с помощью алюминотермии получают металлический хром:
- Cr2O3+2Al→Al2O3+2Cr+130kcal{\displaystyle {\mathsf {Cr_{2}O_{3}+2Al\rightarrow Al_{2}O_{3}+2Cr+130kcal}}}
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
- Cr2O72−+14H++12e−→2Cr+7h3O{\displaystyle {\mathsf {Cr_{2}O_{7}^{2-}+14H^{+}+12e^{-}\rightarrow 2Cr+7H_{2}O}}}
В свободном виде — голубовато-белый металл с кубической объёмноцентрированной решёткой, a = 0,28845 нм. Ниже температуры 38 °C является антиферромагнетиком, выше переходит в парамагнитное состояние (точка Нееля).
Хром имеет твёрдость по шкале Мооса 8.5[6], один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Изотопы[править | править код]
Известны изотопы хрома с массовыми числами от 42 до 67 (количество протонов 24, нейтронов от 18 до 43) и 2 ядерных изомера.
Природный хром состоит из четырех стабильных изотопов (50Cr (изотопная распространённость 4,345 %), 52Cr (83.789 %), 53Cr (9.501 %), 54Cr (2.365 %)).
Среди искусственных изотопов самый долгоживущий 51Cr (период полураспада 27 суток). Период полураспада остальных не превышает одних суток.
Характерные степени окисления[править | править код]
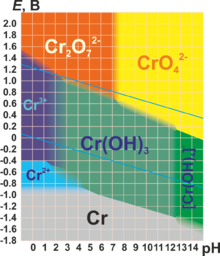
Для хрома характерны степени окисления +2, +3 и +6 (см. табл.). Практически все соединения хрома окрашены[7].
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Cr(OH)2 (жёлтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зелёный) | Амфотерный | Cr3+ (зелёные или лиловые соли) [Cr(OH)4]− (зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | H2CrO4 H2Cr2O7 | Кислотный | CrO42− (хроматы, желтые) Cr2O72− (дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Простое вещество[править | править код]
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)[править | править код]
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
- 2Cr3+→Zn,HCl[H]2Cr2+{\displaystyle {\mathsf {2Cr^{3+}{\xrightarrow[{Zn,HCl}]{[H]}}2Cr^{2+}}}}
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды[8]. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)[править | править код]
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr3+ существует в виде аквакомплексов [Cr(H2O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
- Cr3++3Nh4+3h3O→Cr(OH)3↓+3Nh5+{\displaystyle {\mathsf {Cr^{3+}+3NH_{3}+3H_{2}O\rightarrow Cr(OH)_{3}\downarrow +3NH_{4}^{+}}}}
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
- Cr3++3OH−→Cr(OH)3↓{\displaystyle {\mathsf {Cr^{3+}+3OH^{-}\rightarrow Cr(OH)_{3}\downarrow }}}
- Cr(OH)3+3OH−→[Cr(OH)6]3−{\displaystyle {\mathsf {Cr(OH)_{3}+3OH^{-}\rightarrow [Cr(OH)_{6}]^{3-}}}}
Сплавляя Cr2O3 со щелочами, получают хромиты:
- Cr2O3+2NaOH→2NaCrO2+h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+2NaOH\rightarrow 2NaCrO_{2}+H_{2}O}}}
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
- Cr2O3+6HCl→2CrCl3+3h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+6HCl\rightarrow 2CrCl_{3}+3H_{2}O}}}
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
- 2Na3[Cr(OH)6]+3h3O2→2Na2CrO4+2NaOH+8h3O{\displaystyle {\mathsf {2Na_{3}[Cr(OH)_{6}]+3H_{2}O_{2}\rightarrow 2Na_{2}CrO_{4}+2NaOH+8H_{2}O}}}
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
- 2Cr2O3+8NaOH+3O2→4Na2CrO4+4h3O{\displaystyle {\mathsf {2Cr_{2}O_{3}+8NaOH+3O_{2}\rightarrow 4Na_{2}CrO_{4}+4H_{2}O}}}
Соединения хрома (+4)[править | править код]
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)[править | править код]
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
- 2CrO42−+2H+→Cr2O72−+h3O{\displaystyle {\mathsf {2CrO_{4}^{2-}+2H^{+}\rightarrow Cr_{2}O_{7}^{2-}+H_{2}O}}}
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
- Cr2O72−+2OH−→2CrO42−+h3O{\displaystyle {\mathsf {Cr_{2}O_{7}^{2-}+2OH^{-}\rightarrow 2CrO_{4}^{2-}+H_{2}O}}}
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
- h3CrnO3n+1→h3O+nCrO3{\displaystyle {\mathsf {H_{2}Cr_{n}O_{3n+1}\rightarrow H_{2}O+nCrO_{3}}}}
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
- Ba2++CrO42−→BaCrO4↓{\displaystyle {\mathsf {Ba^{2+}+CrO_{4}^{2-}\rightarrow BaCrO_{4}\downarrow }}}
- 2Ba2++Cr2O72−+h3O→2BaCrO4↓+2H+{\displaystyle {\mathsf {2Ba^{2+}+Cr_{2}O_{7}^{2-}+H_{2}O\rightarrow 2BaCrO_{4}\downarrow +2H^{+}}}}
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
- K2Cr2O7+14HCl→2CrCl3+2KCl+
Сатинированный хром — Варианты покрытий — THG
- Каталог
- Коллекции
- Наши коллекции
- Смесители
- Смесители для кухни
- Аксессуары
- Сантехника
- Дверные и мебельные ручки
- Полотенцесушители
- Все изделия
- Готовые сантехнические решения
- Покрытия
- Список коллекций
- программы
- Каталог PDF
- Вдохновение
- Проекты
- Компания
- Свяжитесь с нами
- Дилеры
- Le Mag
RU
- FR
- EN
- DE
- ES
- CN
- RU
Хромирование — Википедия
 Декоративное хромирование мотоцикла
Декоративное хромирование мотоциклаХроми́рование — диффузионное насыщение поверхности стальных изделий хромом, либо процесс осаждения на поверхность детали слоя хрома из электролита под действием электрического тока. Слой хрома может наноситься для декоративных целей, для обеспечения защиты от коррозии или для увеличения твердости поверхности[1].
 Твердое хромирование
Твердое хромированиеДеталь, подвергаемая хромированию, как правило, проходит через следующие шаги:
- Очистка для удаления сильных загрязнений.
- Тонкая очистка, для удаления следов загрязнений.
- Предварительная подготовка (варьируется в зависимости от материала основы).
- Помещение в ванну с насыщенным раствором и выравнивание температуры.
- Подключение тока и выдержка до получения нужной толщины
Используемые при хромировании реагенты и отходы процесса чрезвычайно токсичны, в большинстве стран этот процесс находится под строгим регулированием.

В промышленности хромирование используется для снижения трения, повышения износостойкости, повышения коррозионной стойкости. Этот процесс обеспечивает повышенную устойчивость стали к газовой коррозии (окалиностойкость) при температуре до 800 °C, высокую коррозионную стойкость в таких средах, как вода, морская вода и азотная кислота. Хромирование сталей содержащих свыше 0,3—0,4 %С, повышает также твёрдость и износостойкость. Твердость хрома составляет от 66 до 70 HRC. Толщина хромового покрытия обычно составляет от 0,075 до 0,25 мм, но встречаются и более толстые, и более тонкие слои. Поверхностные дефекты при хромировании усиливаются и поверхность подлежит последующей обработке, так как хромирование не дает эффекта выравнивания.[2]
Хромирование деталей пар трения, работающих в жёстких условиях (поршневые кольца, зеркало цилиндра ДВС), как показала практика, требует создания покрытия с порами сравнительно крупного размера, способными удерживать масло. Без этого противоизносные и противозадирные свойства покрытия даже хуже, чем у нехромированной детали. Для расширения естественных канальцев на поверхности покрытия используется кратковременное электрохимическое травление обратным током (деталь-анод).
Хромирование используют для деталей паросилового оборудования, пароводяной арматуры, клапанов, вентилей патрубков, а также деталей, работающих на износ в агрессивных средах.
Чёрное хромовое покрытие, полученное в ванне специального состава (не путать с декоративной виниловой плёнкой), отличается большим светопоглощением в сочетании с гладкостью и используется там, где необходимо отсутствие бликов (оптические приборы, автомобильные детали в поле зрения водителя и т.п.)
В отдельных случаях хромирование применяется для ремонта деталей путём наращивания сопрягаемой поверхности в случае прослабленной посадки. В настоящее время может использоваться как «гаражная» или «холодная» альтернатива плазменному напылению металла, аналогичного материалу детали.
Типичными являются следующие растворы для хромирования:
- Шестивалентный хром, чей основной ингредиент — хромовый ангидрид.
- Трехвалентный хром, чей основной ингредиент — Сульфат хрома или хлорид хрома. Ванны с трехвалентным хромом используются довольно редко из-за ограничений, накладываемых на цвет, яркость и толщину покрытия.[источник не указан 3798 дней]
Типичное содержание ванны с шестивалентным хромом:
Нарушение состава и температуры ванны легко приводит к разнообразным дефектам покрытия (пятна, матовость, отслаивание), разрушению свинцовой футеровки ванны. При превышении плотности тока на краях и углах деталей могут образовываться наросты-дендриты разнообразной формы — «сувениры из гальванического цеха».
Нанесение хрома на самопассивирующиеся металлы (алюминий, титан) затруднено и требует тщательной предварительной очистки травлением или производится по подслою другого металла (медь, никель). Может потребоваться подключение источника тока до помещения детали в ванну.
Хромирование стали по подслою улучшает антикоррозионные свойства покрытия, перекрывая естественные микропоры хрома; в то же время подслой никеля образует с хромом гальваническую пару и может корродировать сам по себе вплоть до отслаивания хрома. Для закрытия пор хрома может применяться насыщение поверхности плёнки лаками или маслами, в том числе при повышенной температуре или под вакуумом.
Полученный на деталях слой хрома, как правило, сравнительно хрупок, и для улучшения его свойств может применяться термообработка в виде длительной выдержки при температуре порядка 200°C.
Электролитическое хромирование пластмасс производится по предварительно напылённому или осаждённому слою другого металла, например, меди.
После того, как шестивалентный хром в 90-е годы XX века был признан канцерогеном, в различных странах началась разработка методик его замены. Так, в США и Канаде начала работу Hard Chrome Alternаtive team, HCAT. В 2003 году была принята и в 2006 году вступила в силу директива RoHS, которая существенно ограничила применение хромирования в Европе. Результатом стала замена хромирования на другие способы обработки, например, высокоскоростное газопламенное напыление во многих применениях.
- Ю.М. Лахтин, В.П. Леонтьева. Материаловедение. — М.: Машиностроение, 1990.
Внимание! Если Вы обнаружили ошибку на сайте, то выделите ее и нажмите Ctrl+Enter.
|
|
