Транзистор МП20 — DataSheet
Перейти к содержимому
Цоколевка транзисторов МП16, МП20
| Параметр | Обозначение | Маркировка | Условия | Значение | Ед. изм. |
| Аналог | МП20А | АС121, ASY26 | |||
| МП20Б | АС125, АС132 | ||||
| Структура | — | p-n-p | мВт | ||
| Максимально допустимая постоянная рассеиваемая мощность коллектора | PK max,P*K, τ max,P**K, и max | А | — | 150 | |
| Б | — | 150 | |||
| Граничная частота коэффициента передачи тока транзистора для схемы с общим эмиттером | fгр, f*h31б, f**h31э, f***max | А | — | ≥2* | МГц |
| Б | — | ≥1. 5* 5* | |||
| Пробивное напряжение коллектор-база при заданном обратном токе коллектора и разомкнутой цепи эмиттера | А | — | 30 | В | |
| Б | — | 30 | |||
| Пробивное напряжение эмиттер-база при заданном обратном токе эмиттера и разомкнутой цепи коллектора | UЭБО проб., | А | — | 30 | В |
| Б | — | 30 | |||
| Максимально допустимый постоянный ток коллектора | IK max, I*К , и max | А | — | 300* | мА |
| Б | — | 300* | |||
| Обратный ток коллектора — ток через коллекторный переход при заданном обратном напряжении коллектор-база и разомкнутом выводе эмиттера | IКБО, I*КЭR, I**КЭO | А | 30 В | 50 | мкА |
| Б | 30 В | 50 | |||
| Статический коэффициент передачи тока транзистора в режиме малого сигнала для схем с общим эмиттером | h21э, h*21Э | А | 5 В; 25 мА | 50…150 | |
| Б | 5 В; 25 мА | 80…200 | |||
| Емкость коллекторного перехода | cк, с*12э | А | — | — | пФ |
| Б | — | — | |||
| Сопротивление насыщения между коллектором и эмиттером | rКЭ нас, r*БЭ нас | А | — | ≤1 | Ом |
| Б | — | ≤1 | |||
| Коэффициент шума транзистора | Кш, r*b, Pвых | А | — | — | Дб, Ом, Вт |
| Б | — | — | |||
| Постоянная времени цепи обратной связи на высокой частоте | τк, t*рас, t**выкл, t*** | А | — | — | пс |
| Б | — | — |
Описание значений со звездочками(*,**,***) смотрите в таблице параметров биполярных транзисторов.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Транзисторы типа: МП20, МП21, МП21А, МП21Б
Транзисторы германиевые сплавные p-n-p переключательные низкочастотные маломощные: МП20, МП21, МП21А, МП21Б. Предназначены для применения в схемах переключения. Выпускаются в металлостеклянном корпусе с гибкими выводами.
Масса транзистора не более 2 грамм.
Чертёж транзистора МП20, МП21, МП21А, МП21Б
Электрические параметры МП20, МП21, МП21А, МП21Б.
| Предельная частота коэффициента передачи тока при UКБ=5 В, IЭ=5 мА, не менее | |
| МП20, МП21, МП21А | 1 МГц |
| МП21Б | 465 кГц |
| Коэффициент передачи тока в режиме малого сигнала при UКБ=5 В, IЭ=25 мА, ƒ=50-1000 Гц | |
| при Т=19,85°С | |
| МП20, МП21А | 50-150 |
| МП21 | 20-60 |
| МП21Б | 20-80 |
| при Т=-60,15°С | |
| МП20, МП21А | 25-150 |
| МП21 | 15-60 |
| МП21Б | 15-80 |
| при Т=69,85°С | |
| МП20 | 20-200 |
| МП21 | 20-75 |
| МП21А | 50-200 |
| МП21Б | 20-110 |
| при Т=19,85°С | |
| МП20 при UКБ=50 В | 0,3 В |
| МП21, МП21А, МП21Б при UКБ=70 В | 0,3 В |
| при Т=69,85°С | |
| МП20 при UКБ=50 В | 0,5 В |
| МП21, МП21А, МП21Б при UКБ=70 В | 0,5 В |
| Граничное напряжение при IЭ=100 мА не менее | |
| МП20 | 30 В |
| МП21, МП21А | |
| МП21Б | 40 В |
| Напряжение насыщения коллектор-эмиттер при IК=300 мА, не более | 0,3 В |
| Обратный ток коллектора не более | |
| при Т=19,85°С | |
| МП20 при UКБ=50 В | 50 мкА |
| МП21, МП21А, МП21Б при UКБ=70 В | 50 мкА |
| при Т=69,85°С | |
| МП20 при UКБ=50 В | 250 мкА |
| МП21, МП21А, МП21Б при UКБ=70 В | 250 мкА |
| Обратный ток эмиттера при Т=19,85°С, U |
50 мкА |
Предельные эксплуатационные данные МП20, МП21, МП21А, МП21Б.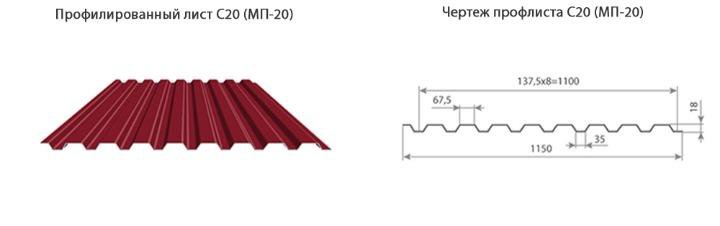
| Постоянное напряжение коллектор-база | |
| МП20 | 50 В |
| МП21, МП21А, МП21Б | 70 В |
| Постоянное напряжение коллектор-эмиттер при RЭБ≤5 кОм | |
| МП20 | 30 В |
| МП21, МП21А | |
| МП21Б | 40 В |
| Постоянное напряжение эмиттер-база | 50 В |
| Импульсный ток коллектора при τи≤10 мкс, Q≥2 | 300 мА |
| Постоянная рассеиваемая мощность | |
| при Т=213-298 К | 150 мВт |
| при Т=343 К | 45 мВт |
| Общее тепловое сопротивление | 330 К/Вт |
| Температура перехода | 84,85°С |
| Температура окружающей среды | От -60,15 до 69,85°С |
1. Зависимость напряжения насыщения коллектор-эмиттер от коэффициента насыщения. 2. Зависимость напряжения насыщения база-эмиттер от коэффициента насыщения. 3. Зависимость времени рассасывания от коэффициента насыщения. 4. Зависимость времени включения от коэффициента насыщения. 5.Зависимость времени включения от тока коллектора. 6. Зависимость коэффициента передачи тока в режиме малого сигнала в схеме с общим эмиттером от тока эмиттера
Зависимость напряжения насыщения коллектор-эмиттер от коэффициента насыщения. 2. Зависимость напряжения насыщения база-эмиттер от коэффициента насыщения. 3. Зависимость времени рассасывания от коэффициента насыщения. 4. Зависимость времени включения от коэффициента насыщения. 5.Зависимость времени включения от тока коллектора. 6. Зависимость коэффициента передачи тока в режиме малого сигнала в схеме с общим эмиттером от тока эмиттера
1. Зависимость напряжения насыщения коллектор-эмиттер от коэффициента насыщения. 2. Зависимость напряжения насыщения база-эмиттер от коэффициента насыщения. 3. Зависимость времени рассасывания от коэффициента насыщения. 4. Зависимость времени включения от коэффициента насыщения. 5.Зависимость времени включения от тока коллектора. 6. Зависимость коэффициента передачи тока в режиме малого сигнала в схеме с общим эмиттером от тока эмиттера.
Каталог профнастила, профнастил для заборов, кровли, стеновой, С8, МП20, НС35, НС44, Н57, Н60, Н75, НС114
Профилированный оцинкованный лист (профнастил оцинкованный) | |||
| Параметры: | |||
Полная ширина от 1200 до 807 мм. | |||
| Монтажная ширина 1150 до 750 мм. | |||
| Толщина листа 0.4 — 0.7 мм. | |||
| Высота профиля от 8 до 114 мм. | |||
Применение оцинкованного профнастила: В основном применяется как несущий материал, но часто используется и для ограждений и как кровельный. Подробнее | |||
Профилированный лист (профнастил) С8 | |||
| Параметры: | |||
| Полная ширина 1200 мм. | |||
| Монтажная ширина 1150 мм. | |||
| Толщина листа 0.4 — 0.7 мм. | |||
| Высота профиля 8 мм. | |||
Применение профлиста С8: Материал для облицовки фасадов и стен, применим также для возведения ограждений. Подробнее | |||
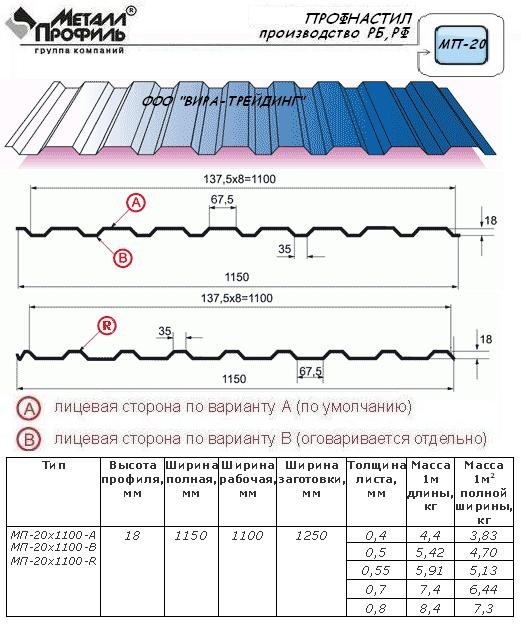
Профилированный лист (профнастил) МП-20 (С-20) | |||
| Параметры: | |||
| Полная ширина 1150 мм. | |||
| Монтажная ширина 1100 мм. | |||
| Толщина листа 0.4 — 0.7 мм. | |||
| Высота профиля 18 мм. | |||
Применение профлиста МП20: 2 конфигурации профиля: кровельная и стеновая. Профнастил используется в зависимости от конфигурации для настила кровли или обустройства ограждений. Подробнее | |||
Профилированный лист (профнастил) НС-35 | |||
| Параметры: | |||
Полная ширина 1060 мм. | |||
| Монтажная ширина 1000 мм. | |||
| Толщина листа 0.4 — 0.7 мм. | |||
| Высота профиля 35 мм. | |||
Применение профлиста НС35: Маркировка говорит сама за себя. Этот профнастил универсален. Несущий и стеновой профнастил в 1 флаконе. Подробнее | |||
Профилированный лист (профнастил) НС-44 | |||
| Параметры: | |||
| Полная ширина 1052 мм. | |||
| Монтажная ширина 1000 мм. | |||
| Толщина листа 0.55 — 0.8 мм. | |||
| Высота профиля 44 мм. | |||
Применение профлиста НС44: НС-44 этот профнастил используется для покрытия кровли с большими пролетами и сооружений, которым приходится выдерживать значительные нагрузки. Подробнее | |||
Профилированный лист (профнастил) Н-57 | |||
| Параметры: | |||
| Полная ширина 960 мм. | |||
| Монтажная ширина 900 мм. | |||
| Толщина листа 0.5 — 1.0 мм. | |||
| Высота профиля 57 мм. | |||
Применение профлиста Н57: Данный вид профнастила не целесообразно и не экономно использовать в качестве облицовки фасадов и возведения ограждений, он несущий и расчитан на большие нагрузки. Подробнее | |||
Профилированный лист (профнастил) Н-60 | |||
| Параметры: | |||
Полная ширина 902 мм. | |||
| Монтажная ширина 845 мм. | |||
| Толщина листа 0.5 — 1.0 мм. | |||
| Высота профиля 60 мм. | |||
Применение профлиста Н60: Профнастил Н60 способен выдерживать значительные статистические и динамические нагрузки. Может использоваться в качестве несъемной опалубки и для настила кровель промышленных сооружений с большими пролетами. Подробнее | |||
Профилированный лист (профнастил) Н-75 | |||
| Параметры: | |||
| Полная ширина 800 мм. | |||
| Монтажная ширина 750 мм. | |||
| Толщина листа 0.5 — 1.0 мм. | |||
| Высота профиля 75 мм. | |||
Применение профлиста Н75: Невероятно прочный материал. Подробнее | |||
Профилированный лист (профнастил) НС-114 | |||
| Параметры: | |||
| Полная ширина 807 мм. | |||
| Монтажная ширина 750 мм. | |||
| Толщина листа 0.5 — 1.0 мм. | |||
| Высота профиля 114 мм. | |||
Применение профлиста НС114: Промышленное строительство, невообразимые нагрузки — назначение этого профлиста. Подробнее | |||
Телефоны
8 800 100 17 62 (бесплатно по всей территории России)
+7 495 543 91 20 (многоканальный)
+7 985 739 17 20
Поделиться:
Корзина
0 элементов
20 — KURZWEIL It’s the Sound®
Перейти к содержимомуMP-20Селеста Сибилла2020-06-16T19:51:27+00:00
ОБЗОР | ХАРАКТЕРИСТИКИ | ИЗОБРАЖЕНИЯ | ВИДЕО | Часто задаваемые вопросы | ЗАГРУЗКИ | ПОДДЕРЖКА | КУПИТЬ
| MP-20 ОБЗОР |
Цифровое пианино MP20 сочетает в себе качество и доступность с 200 лучшими звуками, когда-либо разработанными для профессиональных клавишных инструментов KURZWEIL, и спортивными функциями, специально разработанными для звука, удобства и контроля.
Сочетая в себе традиционный фортепианный дизайн и стиль, модель MP20 доступна в двух профессиональных вариантах отделки: изысканная отделка Ebony Polish имеет классический элегантный вид для более официальных мероприятий, а отделка Satin Rosewood уместна в любой комнате. . Настроенные под уникальным углом корпуса низкочастотных динамиков обеспечивают глубокие басы и повышенную звуковую дисперсию, дополняя широкий звуковой набор инструмента. С твиттерами, расположенными непосредственно за клавишами, создается широкое стереофоническое звуковое поле, оптимизированное как для игрока, так и для аудитории. Простая и интуитивно понятная панель управления MP20 расположена под углом для лучшей видимости/использования и имеет легко сдвигающуюся крышку клавиш.
ЗВУК MP20 использует эксклюзивный звуковой чип Mara от Kurzweil и архитектуру VAST для создания наиболее реалистичных и воспроизводимых звуков инструментов. Цифровые сигналы затем реализуются через подобранные вручную усилители и динамики для создания красивого, но интимного звукового поля.
Цифровые сигналы затем реализуются через подобранные вручную усилители и динамики для создания красивого, но интимного звукового поля.
Звуковая палитра MP20 включает в себя знаменитый рояль KURZWEIL Triple Strike, а также широкий выбор первоклассных и классифицированных инструментов — электрические пианино, органы, оркестровые, ударные, басы, валторны, духовые, гитары, перкуссию и многое другое — все это доступны для создания целых музыкальных произведений, не выходя из собственного дома. (руководство пользователя со списком предустановок доступно для скачивания здесь)
Простые функции разделения и наложения MP20 предлагают еще одно измерение производительности, а кнопки «Избранное» позволяют мгновенно вызывать наиболее необходимые пресеты и пользовательские комбинации.
CONTROL Великолепное управление фортепиано начинается с действия клавиатуры, а MP20 оснащен одной из лучших фирменных клавиатур KURZWEIL с молоточковой механикой. Движение молоточка, а не клавиши, воспринимается для обеспечения максимально точного динамического контроля. Новая клавиатура MP20 распределяет вес молоточка по 4 постепенным зонам от легкого в высоких частотах до тяжелого в басовом конце. Механизм также оснащен спусковым механизмом, который воспроизводит ощущение спуска и зацепления настоящего акустического фортепиано.
Движение молоточка, а не клавиши, воспринимается для обеспечения максимально точного динамического контроля. Новая клавиатура MP20 распределяет вес молоточка по 4 постепенным зонам от легкого в высоких частотах до тяжелого в басовом конце. Механизм также оснащен спусковым механизмом, который воспроизводит ощущение спуска и зацепления настоящего акустического фортепиано.
MP20 также предлагается как MP20F с модернизированным молоточковым затвором Real-Grand™ производства Fatar (Италия).
В дополнение к клавишному действию, MP20 оснащен всеми 3 встроенными педалями стандартного акустического пианино (сустейн, состенуто и приглушенный), а также дополнительным входом для педали громкости/экспрессии, облегчающим динамичное исполнение.
Все технические характеристики могут быть изменены без предварительного уведомления.
Все технические характеристики могут быть изменены без предварительного уведомления.
| Клавиатура: | 88-клавишная, полностью взвешенная, градуированная молоточковая клавиатура с регулируемыми сенсорными клавишами MP20: LK-40 GH |
| Чувствительность клавиатуры: | 10 выбираемых уровней отклика |
| Дисплей: | Буквенно-цифровой светодиод с прокруткой |
| Полифония: | 64 голоса |
| Предустановленные программы: | 200 выразительных тембров, включая удостоенный наград рояль Triple Strike (руководство пользователя со списком предустановок доступно для скачивания здесь) |
| Пользовательские настройки: | 6, вызываемые одним касанием «избранное», обеспечивающие быстрый доступ к индивидуальному выбору.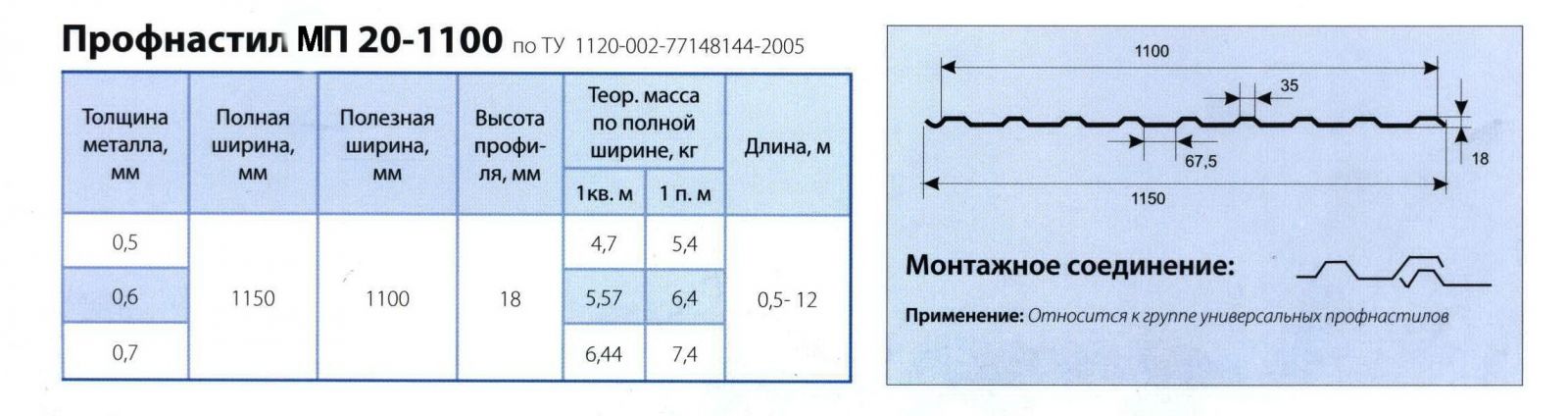 |
| Демонстрационные песни: | 51 фортепианная демонстрация |
| Общий MIDI: | № |
| Разделения/слои: | Quick Split/Layer, удобный доступ с регулируемой относительной громкостью |
| Транспонирование: | Полная транспозиция в любую тональность, +/- две октавы |
| Мелодия: | Настроить по центам (+/- 100 центов) |
| Эффекты: | Двойной процессор окружения и эффектов (реверберация и хорус). Богатые и сложные эффекты из серии PC3. |
| Модели ударных: | 100 предварительно записанных интерактивных шаблонов в различных стилях |
| Метроном: | Да |
| Рекордер/секвенсор: | 2-дорожечный; Вместимость 20 песен |
| Звуковая система: | 50-ваттная стереосистема с 4 динамиками |
| Аудиовыходы: | Стерео левый/правый линейные выходы RCA (для подключения к внешнему усилителю) |
| Аудиовходы: | Стерео левый/правый линейные входы RCA (для подключения внешних источников звука) |
| Наушники: | (2) 1/4-дюймовые стереовыходы для наушников |
| MIDI-вход/выход: | Разъемы входа и выхода MIDI |
| USB: | (1) порт; USB-функция «Plug and Play» позволяет использовать MIDI через USB для подключения к/от внешнего компьютерного секвенсора; драйвер программного обеспечения не требуется |
| Педали: | (3) встроенный переключатель типа: сустейн, состенуто, софт (1) Непрерывный вход регулятора громкости/педали экспрессии |
| Отделка: | Имитация палисандра, полировка черного дерева |
| Скамья: | Соответствующая скамья в комплекте |
| Размеры: | 34,5″ (В) x 54,75″ (Ш) x 19,6″ (Г) 87,6 см (В) x 139,1 см (Ш) x 49,8 см (Г) |
| Вес: | 156 фунтов / 71 кг |
| Мощность: | Внешний источник питания без напряжения 90–250 В перем. тока; 19 В 3,42 А постоянного тока тока; 19 В 3,42 А постоянного тока |
| ИЗОБРАЖЕНИЯ |
| ВИДЕО |
Цифровое домашнее пианино MP20
Обзор функций MP20
6 Вопрос: Как я могу удалить дорожки определенной песни или полностью стереть данную песню на моем MP20/MPS20? Ответ:
Чтобы стереть отдельные треки песен:
- Выберите пользовательскую композицию для работы с :-Нажмите кнопку [Rhythm].-Нажмите кнопку категории [User].-Используйте кнопки [+Next] и/или [Prev-] для выбора: U1 — U20.

- Нажмите кнопку дорожки, соответствующую той дорожке, которую вы хотите стереть, например: [Дорожка 1].
- Нажмите [Запись].
- Нажмите [Play/Stop], чтобы начать. Пусть песня воспроизводится на протяжении всей ее продолжительности. Не играйте на клавишах пианино.
- Нажмите [Play/Stop], когда будет достигнут конец песни.
- Нажмите [Сохранить], чтобы сохранить.
Примечание. Этот метод позволяет удалить только дорожку 1 и/или дорожку 2. Он НЕ позволяет удалять какой-либо ритм, используемый при записи.
Чтобы полностью стереть пользовательскую песню (включая ритм):
- Нажмите кнопку [Ритм].
- С помощью кнопок [+Next] и/или [Prev-] выберите #351 «No Rhythm». Ритм № 351 — «пустой». (обычно двигаясь назад по списку, нажимая [Prev -] несколько раз, вы попадете туда быстрее).
- При выбранном ритме №351 нажмите [Record].

- Нажмите [Play/Stop] (вы можете нажать [Play/Stop] в любое время после запуска).
Вам будет предложено «СОХРАНИТЬ РИТМ КАК UX?» — где «X» соответствует номеру пользовательской композиции (1-20).
- С помощью кнопок [+Next] и/или [Prev-] выберите пользовательскую песню для удаления, например, «U1».
- Нажмите [Save], и выбранная песня пользователя (U1 в нашем примере) будет полностью стерта.
Вопрос: Как включить тренировочный метроном в моем MP20/MPS20? Ответ: Чтобы включить метроном, нажмите, чтобы попрактиковаться вместе с:
- Нажмите кнопку [Ритм].
- С помощью кнопок [+Next] и/или [Prev-] выберите один из 5 доступных встроенных паттернов метронома (ID #301-305). Например: #305 — это простой метроном на 1/4 ноты (подробности см.
 в списке «Ритмические паттерны» на стр. 43 в руководстве).
в списке «Ритмические паттерны» на стр. 43 в руководстве). - Чтобы установить темп, нажмите кнопку [Tempo], затем с помощью кнопок [+Next] и/или [Prev-] выберите желаемый темп (диапазон = 20~300 ударов в минуту).
- Нажмите [Play/Stop], чтобы запустить метроном.
- Нажмите [Play/Stop] еще раз, чтобы остановить метроном.
Сведения об использовании
- Отрегулируйте громкость метронома :-Нажмите кнопку [Rhythm].-Нажмите кнопки [Select] для выбора параметра «VOL:X» (диапазон = 1~9).-Используя кнопки [+Next] и/или [Prev-] для выбора уровня громкости.
- Сохранить метроном как избранное :-Нажмите и удерживайте одну из шести кнопок [Избранное] в течение 2 секунд. для сохранения текущего образца ритма/метронома и выбора тембра в этом выбранном месте. — Выбранный вариант можно вызвать в любое время, нажав ту же кнопку [Favorite] еще раз.

Вопрос: Как включить тренировочный метроном в моем MP20/MPS20? Ответ: Чтобы включить метроном, нажмите, чтобы попрактиковаться вместе с:
- Нажмите кнопку [Ритм].
- С помощью кнопок [+Next] и/или [Prev-] выберите один из 5 доступных встроенных паттернов метронома (ID #301-305). Например: #305 — это простой метроном на 1/4 ноты (подробности см. в списке «Ритмические паттерны» на стр. 43 в руководстве).
- Чтобы установить темп, нажмите кнопку [Tempo], затем с помощью кнопок [+Next] и/или [Prev-] выберите желаемый темп (диапазон = 20~300 ударов в минуту).
- Нажмите [Play/Stop], чтобы запустить метроном.
- Нажмите [Play/Stop] еще раз, чтобы остановить метроном.
Сведения об использовании
- Отрегулируйте громкость метронома :-Нажмите кнопку [Rhythm].
 -Нажмите кнопки [Select] для выбора параметра «VOL:X» (диапазон = 1~9).-Используя кнопки [+Next] и/или [Prev-] для выбора уровня громкости.
-Нажмите кнопки [Select] для выбора параметра «VOL:X» (диапазон = 1~9).-Используя кнопки [+Next] и/или [Prev-] для выбора уровня громкости.
- Отрегулируйте громкость метронома :-Нажмите кнопку [Rhythm].
- Сохранить метроном как избранное :-Нажмите и удерживайте одну из шести кнопок [Избранное] в течение 2 секунд. для сохранения текущего образца ритма/метронома и выбора тембра в этом выбранном месте. — Выбранный вариант можно вызвать в любое время, нажав ту же кнопку [Favorite] еще раз.
Вопрос: Как я могу удалить дорожки определенной песни или полностью стереть данную песню на моем MP20/MPS20? Ответ:
Чтобы стереть отдельные треки песен:
- Выберите пользовательскую композицию для работы с :-Нажмите кнопку [Rhythm].-Нажмите кнопку категории [User].-Используйте [+Next] и/ или кнопки [Prev-] для выбора: U1 — U20.

- Нажмите кнопку дорожки, соответствующую той дорожке, которую вы хотите стереть, например: [Дорожка 1].
- Нажмите [Запись].
- Нажмите [Play/Stop], чтобы начать. Пусть песня воспроизводится на протяжении всей ее продолжительности. Не играйте на клавишах пианино.
- Нажмите [Play/Stop], когда будет достигнут конец песни.
- Нажмите [Сохранить], чтобы сохранить.
Примечание. Этот метод позволяет удалить только дорожку 1 и/или дорожку 2. Он НЕ позволяет удалять какой-либо ритм, используемый при записи.
Чтобы полностью стереть пользовательскую композицию (включая ритм):
- Нажмите кнопку [Ритм].
- С помощью кнопок [+Next] и/или [Prev-] выберите #351 «No Rhythm». Ритм № 351 — «пустой». (обычно двигаясь назад по списку, нажимая [Prev -] несколько раз, вы попадете туда быстрее).
- При выбранном ритме №351 нажмите [Record].

- Нажмите [Play/Stop] (вы можете нажать [Play/Stop] в любое время после запуска).
Вам будет предложено «СОХРАНИТЬ РИТМ КАК UX?» — где «X» соответствует номеру пользовательской композиции (1-20).
- С помощью кнопок [+Next] и/или [Prev-] выберите пользовательскую песню для удаления, например, «U1».
- Нажмите [Save], и выбранная песня пользователя (U1 в нашем примере) будет полностью стерта.
Вопрос: Каковы шаги для записи с использованием разделений/слоев? Ответ:
Дорожка записи 1
- Выберите голос, который вы хотите использовать для дорожки 1. Если вы сохранили разделенный или наложенный звук в Избранное, вы можете выбрать один из них.
- Если вы включили ритмы для записи (см. ниже в разделе «Примечания по использованию»), нажмите кнопку «Ритм» и выберите паттерн для записи.

- Нажмите [Дорожка 1]
- Нажмите [Запись]
Если вы используете метроном, он будет отсчитывать один такт перед началом записи (см. ниже в разделе «Примечания по использованию»).
- Нажмите [Play/Stop], чтобы начать запись.
- Исполнить песню сейчас.
- Нажмите [Play/Stop], чтобы остановить запись.
Светодиод кнопки Save начинает мигать, и на дисплее отображается SAVE RHYTHM AS:(U1 – U20). Они представляют собой расположение песен пользователя. В наличии 20.
- Нажмите кнопку [+Next], чтобы выбрать номер пользовательской композиции (U1–U20) для сохранения.
- Нажмите кнопку [Сохранить]. Теперь ваша песня сохранена в указанном выше месте с песнями пользователя.
Дорожка записи 2
- Выберите голос, который вы хотите использовать для дорожки 2.
 Если вы сохранили разделенный или наложенный звук в Избранное, вы можете выбрать один из них.
Если вы сохранили разделенный или наложенный звук в Избранное, вы можете выбрать один из них. - Выберите нужную пользовательскую композицию для записи: — Нажмите кнопку [Rhythm]. — Нажмите кнопку [User] (кнопка в правом верхнем углу на дальнем конце, над «Demo») — Нажмите [Prev-] или [Next+] для перехода к нужной песне (от U1 до U20).
- Нажмите [Дорожка 2]
- Нажмите [Запись]. На дисплее появится сообщение RECORD READY.
- Нажмите [Play/Stop], чтобы начать запись.
- Сейчас же исполните второй трек своей песни. Трек 1 будет воспроизводиться, пока вы записываете трек 2.
- Нажмите [Play/Stop], чтобы остановить запись.
- Выберите голос, который вы хотите использовать для дорожки 2.
Как и раньше, индикатор кнопки Save начинает мигать, а на дисплее отображается SAVE RHYTHM AS:(U1 – U20). Теперь вы можете сохранить свою песню в том же месте для пользовательской песни или выбрать новое место, если хотите.
- При необходимости нажмите кнопку [+Next], чтобы выбрать номер пользовательской композиции (U1–U20) для сохранения.

- Нажмите кнопку [Сохранить]. Теперь ваша песня сохранена в указанном выше месте с песнями пользователя.
ПРИМЕЧАНИЯ ПО ИСПОЛЬЗОВАНИЮ
Включение ритмов во время записи- Нажмите кнопку [Function] для входа в режим функций.
- Нажмите кнопку [Select] ▲ и ▼, чтобы просмотреть список параметров и найти REC RHYTHM.
- Нажмите кнопку [Prev-] или [+Next], чтобы изменить значение на ON (значение по умолчанию для параметра REC RHYTHM равно OFF — если установлено OFF, ритм аккомпанемента не будет запускаться).
- Нажмите кнопку [Function] еще раз, чтобы выйти из функционального режима.
- Нажмите кнопку [Function] для входа в режим функций.
- Нажмите кнопку [Select] ▲ и ▼, чтобы просмотреть список параметров и найти METRO.
- Нажмите кнопку [Prev-] или [+Next], чтобы изменить значение на REC (слышно только во время записи) или ON (слышно во время записи и воспроизведения).
 (значение по умолчанию для параметра METRO – OFF – если установлено OFF, метроном не будет запускаться).
(значение по умолчанию для параметра METRO – OFF – если установлено OFF, метроном не будет запускаться). - Нажмите кнопку [Function] еще раз, чтобы выйти из функционального режима.
Вопрос: Как восстановить заводские настройки MP20/MPS20 по умолчанию? Ответ: Примечание. При выполнении аппаратного сброса все песни, записанные пользователем, будут удалены, а для всех параметров будут восстановлены значения по умолчанию. Это действие не может быть отменено. Есть два метода:
Способ включения питания:
- Удерживая нажатой клавишу C8, включите питание.
- Продолжайте удерживать кнопку C8, пока на дисплее не появится надпись «RESETTING» (прокрутка), затем отпустите.
Метод меню функций:
- Нажмите функциональную кнопку.

- Нажимайте кнопки Select [Вверх] или [Вниз] для перемещения по меню функций (вперед и назад) и найдите параметр Hard Reset: На дисплее появится (прокручивается): «Hard Reset?»
- Нажмите [Next+]. На дисплее появится (прокрутка): «Подтвердить?»
- Нажмите [Next+] еще раз, чтобы выполнить сброс.
В любом случае устройство сотрет свою пользовательскую память, восстановит все заводские настройки и перезагрузится.
Работа с USB_MIDI и Windows Vista/Win7/8 Вопрос: У меня возникли трудности с тем, чтобы заставить мой ПК с Windows под управлением Vista/Win7/8 выводить MIDI на мой Kurzweil через USB. Нужно ли устанавливать драйвер? Ответ: Нет. Текущая линейка продуктов Kurzweil имеет стандартную совместимую с классом реализацию USB-MIDI. Они не требуют установки каких-либо дополнительных драйверов. Некоторая предыстория, о которой следует знать: Microsoft неуклонно УДАЛЯЕТ MIDI-ФУНКЦИИ из Windows, начиная с Vista. В Windows XP Microsoft предоставила панель управления MIDI Mapper, которая позволяла конечным пользователям выбирать устройство вывода MIDI. Начиная с Vista это было недоступно. Таким образом, некоторые приложения (такие как Windows Media Player — WMP) больше не могут воспроизводить MIDI-композиции, запускающие внешние MIDI-устройства , потому что WMP направляется только на внутренний синтезатор Microsoft GS . Это означает, что MIDI-приложение, которое вы решите использовать, должно изначально предлагать свои собственные встроенные возможности отображения MIDI ИЛИ вы можете установить сторонний MIDI-преобразователь, целью которого является замена возможностей маршрутизации MIDI, удаленных из Windows. К счастью,
В наши дни большинство коммерческих программных продуктов MIDI для ПК, таких как Cubase или Cakewalk, имеют экран конфигурации, который включает сопоставление MIDI-устройства, необходимое для маршрутизации на внешнее MIDI-устройство.
В Windows XP Microsoft предоставила панель управления MIDI Mapper, которая позволяла конечным пользователям выбирать устройство вывода MIDI. Начиная с Vista это было недоступно. Таким образом, некоторые приложения (такие как Windows Media Player — WMP) больше не могут воспроизводить MIDI-композиции, запускающие внешние MIDI-устройства , потому что WMP направляется только на внутренний синтезатор Microsoft GS . Это означает, что MIDI-приложение, которое вы решите использовать, должно изначально предлагать свои собственные встроенные возможности отображения MIDI ИЛИ вы можете установить сторонний MIDI-преобразователь, целью которого является замена возможностей маршрутизации MIDI, удаленных из Windows. К счастью,
В наши дни большинство коммерческих программных продуктов MIDI для ПК, таких как Cubase или Cakewalk, имеют экран конфигурации, который включает сопоставление MIDI-устройства, необходимое для маршрутизации на внешнее MIDI-устройство.
| ОПОРА |
Связаться с отделом предпродаж
У вас есть вопросы, на которые нужно ответить перед покупкой?
Регистрация продукта
Зарегистрируйте новый продукт у местного дистрибьютора.
Связаться со службой поддержки дистрибьюторов
У вас есть вопросы по использованию или применению вашего продукта Kurzweil?
Обратитесь в сервис/ремонт
Нужен ремонт? Нужно найти местный авторизованный сервисный центр? получить запчасти?
Авторизованная ремонтная мастерская
Найдите ближайшую ремонтную мастерскую Kurzweil.
Перейти к началу
MP20, второй по распространенности белок мембраны хрусталика и член суперсемейства тетраспанинов, присоединяется к списку лигандов галектина-3 | BMC Molecular and Cell Biology
- Исследовательская статья
- Открытый доступ
- Опубликовано:
- Tamir Gonen 1 ,
- Angus C Grey 2 ,
- Marc D Jacobs 2 ,
- Paul J Donaldson 2 &
- …
- Joerg Kistler 1
BMC Клеточная биология том 2 , номер статьи: 17 (2001) Процитировать эту статью
9357 Доступ
38 цитирований
3 Альтметрика
Сведения о показателях
Abstract
Background
Хотя MP20 является вторым по экспрессии мембранным белком в хрусталике, его функция остается загадкой.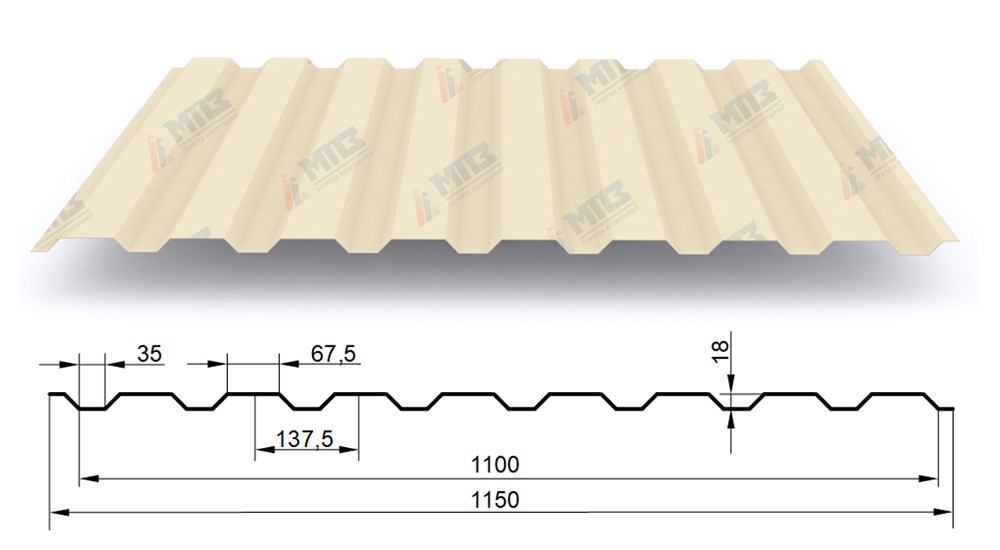 Предполагаемые функции MP20 недавно были выведены из его отнесения к тетраспаниновому суперсемейству интегральных мембранных белков. Было показано, что члены этого семейства участвуют в клеточной пролиферации, дифференцировке, миграции и адгезии. В этом исследовании мы показываем, что MP20 связывается с галектином-3, известным модулятором адгезии.
Предполагаемые функции MP20 недавно были выведены из его отнесения к тетраспаниновому суперсемейству интегральных мембранных белков. Было показано, что члены этого семейства участвуют в клеточной пролиферации, дифференцировке, миграции и адгезии. В этом исследовании мы показываем, что MP20 связывается с галектином-3, известным модулятором адгезии.
Результаты
MP20 и галектин-3 совместно локализованы в выбранных областях плазматической мембраны клеток волокон хрусталика. По отдельности эти очищенные белки имели кажущуюся молекулярную массу 60 кДа и 22 кДа соответственно. Комплекс 104 кДа образовался in vitro при смешивании очищенных белков. Комплекс MP20 и галектина-3 с молекулярной массой 102 кДа также может быть выделен из растворимых в детергенте клеточных мембран нативных волокон. Связывание между MP20 и галектином-3 было нарушено лактозой, что позволяет предположить, что лектиновый сайт был вовлечен во взаимодействие.
Выводы
MP20 добавляется к растущему списку лигандов галектина-3 и, по-видимому, является первым представителем надсемейства тетраспанинов, обладающим этой специфичностью.
История вопроса
Тетраспанины составляют надсемейство интегральных мембранных белков, которые имеют общую мембранную топологию, характеризующуюся четырьмя трансмембранными сегментами и расположением амино- и карбокси-концов на цитоплазматической поверхности [1]. Кроме того, большинство членов имеют консенсусный сайт N-связанного гликозилирования в одной из внеклеточных петель [2]. Тетраспанины участвуют во множестве клеточных процессов, включая активацию, пролиферацию, дифференцировку, миграцию, адгезию и апоптоз [3]. Тетраспанины образуют контакты с другими клетками или внеклеточным матриксом, связываясь с другими тетраспанинами, с рецепторами адгезии, такими как интегрины, и с внеклеточными белками [4-6].
Семейство генов PMP22/EMP/MP20 является подсемейством тетраспанинов [7]. PMP22, также известный как CD25, связан с апоптозом фибробластов [8]. Он также экспрессируется в миелинизирующих шванновских клетках, где играет роль в дифференцировке [9–11]. Когда он отсутствует или дисфункционален, он вызывает периферические невропатии, которые приводят к прогрессирующей слабости дистальных мышц [12]. Этот отчет касается MP20 [13, 14]. Ранее также обозначаемый как MP17 и MP18, это второй наиболее распространенный интегральный мембранный белок клеток волокон хрусталика, который, по-видимому, равномерно распределен в плазматической мембране, но также встречается в отдельных доменах мембранного соединения [15-17]. Мутации в MP20 серьезно нарушают нормальное расположение клеток хрусталика в хрусталике и вызывают катарактогенез [18, 19].]. Это указывает на важную роль MP20 в мембранах клеток хрусталика, но его функциональная связь с др. белками остается загадкой. Недавно галектин-3 был идентифицирован как ассоциированный с мембраной белок хрусталика [20]. В других тканях галектин-3 действует как модулятор адгезии [21–23]. Таким образом, кажется, что MP20 и galectin-3 имеют общее участие в адгезивных процессах, что повышает вероятность того, что они могут быть партнерами по связыванию в хрусталике. В настоящем отчете показано, что MP20 и галектин-3 совместно локализуются в выбранных областях клеточной плазматической мембраны.
Этот отчет касается MP20 [13, 14]. Ранее также обозначаемый как MP17 и MP18, это второй наиболее распространенный интегральный мембранный белок клеток волокон хрусталика, который, по-видимому, равномерно распределен в плазматической мембране, но также встречается в отдельных доменах мембранного соединения [15-17]. Мутации в MP20 серьезно нарушают нормальное расположение клеток хрусталика в хрусталике и вызывают катарактогенез [18, 19].]. Это указывает на важную роль MP20 в мембранах клеток хрусталика, но его функциональная связь с др. белками остается загадкой. Недавно галектин-3 был идентифицирован как ассоциированный с мембраной белок хрусталика [20]. В других тканях галектин-3 действует как модулятор адгезии [21–23]. Таким образом, кажется, что MP20 и galectin-3 имеют общее участие в адгезивных процессах, что повышает вероятность того, что они могут быть партнерами по связыванию в хрусталике. В настоящем отчете показано, что MP20 и галектин-3 совместно локализуются в выбранных областях клеточной плазматической мембраны. Биохимический анализ подтвердил, что MP20 и галектин-3 взаимодействуют друг с другом. Таким образом, MP20 следует добавить в растущий список лигандов галектина-3. MP20 является первым членом суперсемейства тетраспанинов, обладающим такой специфичностью связывания.
Биохимический анализ подтвердил, что MP20 и галектин-3 взаимодействуют друг с другом. Таким образом, MP20 следует добавить в растущий список лигандов галектина-3. MP20 является первым членом суперсемейства тетраспанинов, обладающим такой специфичностью связывания.
Результаты
Совместная локализация MP20 и галектина-3 в клетках волокон хрусталика
Было показано, что и MP20, и галектин-3 экспрессируются в клетках волокон хрусталика [15–17, 20]. Предполагаемое участие обоих белков в процессах адгезии повышает вероятность того, что они взаимодействуют друг с другом в клеточных мембранах волокон хрусталика. В качестве первого шага для изучения этой возможности пространственное распределение этих двух белков было определено с помощью иммуноцитохимии (рис. 1). MP20 широко экспрессировался в хрусталике, как в клетках удлиняющихся волокон вблизи периферии хрусталика, так и в зрелых клетках глубже в хрусталике, которые уже потеряли клеточные ядра (рис. 1А). В клетках периферических удлиняющихся волокон значительная часть MP20, по-видимому, сконцентрирована в везикулах, что, возможно, представляет собой состояние предшественника для встраивания в плазматическую мембрану (рис. 1В). Точно так же галектин-3, по-видимому, присутствовал преимущественно в везикулах, иногда в тех же, что и для MP20 (рис. 1В). Совершенно другая картина наблюдалась в зрелых волокнистых клетках глубже в хрусталике: и MP20, и галектин-3 были полностью ассоциированы с мембраной (рис. 1С). MP20 более равномерно распределялся в плазматической мембране, чем галектин-3, который имел более точечный вид. Во многих областях два белка, по-видимому, совместно локализовались, подтверждая представление о том, что они могут взаимодействовать друг с другом. Некоторое количество галектина-3 также локализуется в областях мембраны, где отсутствует MP20, что позволяет предположить, что галектин-3 также может иметь других партнеров по связыванию.
1В). Точно так же галектин-3, по-видимому, присутствовал преимущественно в везикулах, иногда в тех же, что и для MP20 (рис. 1В). Совершенно другая картина наблюдалась в зрелых волокнистых клетках глубже в хрусталике: и MP20, и галектин-3 были полностью ассоциированы с мембраной (рис. 1С). MP20 более равномерно распределялся в плазматической мембране, чем галектин-3, который имел более точечный вид. Во многих областях два белка, по-видимому, совместно локализовались, подтверждая представление о том, что они могут взаимодействовать друг с другом. Некоторое количество галектина-3 также локализуется в областях мембраны, где отсутствует MP20, что позволяет предположить, что галектин-3 также может иметь других партнеров по связыванию.
Пространственное распределение MP20 и галектина-3 в хрусталике. (A) Обзор распределения MP20 (красный) по отношению к ядрам клеток (синий) в качестве маркера дифференцировки волокнистых клеток в экваториальных срезах. (B) Совместная локализация MP20 (красный) и галектина-3 (зеленый) в периферической коре, как показано рамкой b на панели A. (C) Совместная локализация MP20 и галектина-3 в области примерно 500 м вглубь коры головного мозга, как показано рамкой c на панели A. Желтый цвет указывает на области перекрытия обоих белков.
(B) Совместная локализация MP20 (красный) и галектина-3 (зеленый) в периферической коре, как показано рамкой b на панели A. (C) Совместная локализация MP20 и галектина-3 в области примерно 500 м вглубь коры головного мозга, как показано рамкой c на панели A. Желтый цвет указывает на области перекрытия обоих белков.
Изображение в полный размер
Следуя наблюдениям, что MP20 и галектин-3 совместно локализованы во многих областях плазматической мембраны волокнистых клеток, мы теперь исследуем их способность биохимически связываться друг с другом, используя два протокола. В первом протоколе мы отдельно очистили MP20 и галектин-3 и охарактеризовали их молекулярную массу. Затем очищенные белки объединяли и смесь анализировали на образование комплексов. Во втором протоколе были оптимизированы условия для солюбилизации нативных комплексов MP20 и галектина-3 непосредственно из клеточных мембран волокон.
Биохимическая очистка MP20 и галектина-3
MP20 очищали по предыдущей методике [26] с некоторыми модификациями.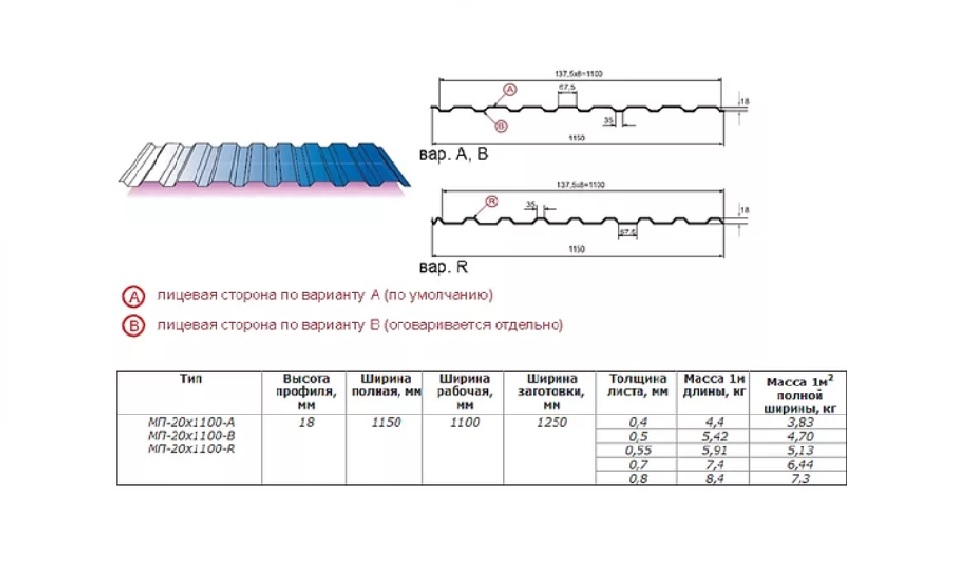 Результаты отдельных этапов процедуры представлены на рисунке 2. Клеточные мембраны овечьих волокон были «полностью очищены» от периферических белков, оставив преимущественно основные интегральные мембранные белки, включая основной внутренний полипептид (MIP) 26 кДа и его расщепленную форму 22 кДа. MP20 (20 кДа) и расщепленную форму коннексина 46 и 50 массой 38 кДа (рис. 2А, дорожка 2). N-децил-бета-D-мальтопиранозид (DM) солюбилизировал более 50% MP20 вместе с различными количествами других интегральных мембранных белков (рис. 2А, дорожка 4). Все эти белки, включая около половины MP20, связаны с колонкой MonoQ. Другая половина MP20 появилась в проточной фракции и, таким образом, могла быть легко отделена от других белков (рис. 2B, стрелка; рис. 2A, дорожка 5). Иммуноблоттинг-анализ подтвердил идентичность MP20. Обратите внимание, что антитело также распознает димер MP20, который обычно не обнаруживается в окрашенных гелях (рис. 2А, дорожка 8). Гель-фильтрация также показала, что MP20 существует в виде олигомера: белок элюировался с колонки в виде одного пика на 15 мл (v o = 8 мл), что дает его кажущуюся молекулярную массу 60 кДа (Фигура 2A, дорожка 7, C и D).
Результаты отдельных этапов процедуры представлены на рисунке 2. Клеточные мембраны овечьих волокон были «полностью очищены» от периферических белков, оставив преимущественно основные интегральные мембранные белки, включая основной внутренний полипептид (MIP) 26 кДа и его расщепленную форму 22 кДа. MP20 (20 кДа) и расщепленную форму коннексина 46 и 50 массой 38 кДа (рис. 2А, дорожка 2). N-децил-бета-D-мальтопиранозид (DM) солюбилизировал более 50% MP20 вместе с различными количествами других интегральных мембранных белков (рис. 2А, дорожка 4). Все эти белки, включая около половины MP20, связаны с колонкой MonoQ. Другая половина MP20 появилась в проточной фракции и, таким образом, могла быть легко отделена от других белков (рис. 2B, стрелка; рис. 2A, дорожка 5). Иммуноблоттинг-анализ подтвердил идентичность MP20. Обратите внимание, что антитело также распознает димер MP20, который обычно не обнаруживается в окрашенных гелях (рис. 2А, дорожка 8). Гель-фильтрация также показала, что MP20 существует в виде олигомера: белок элюировался с колонки в виде одного пика на 15 мл (v o = 8 мл), что дает его кажущуюся молекулярную массу 60 кДа (Фигура 2A, дорожка 7, C и D). Это согласуется с димером MP20, связанным со значительным количеством детергента, или, что менее вероятно, с тримером без детергента.
Это согласуется с димером MP20, связанным со значительным количеством детергента, или, что менее вероятно, с тримером без детергента.
Очистка и определение характеристик линзы MP20. (A) SDS-PAGE и документация по вестерн-блоттингу процесса очистки. Дорожка 1: Маркеры молекулярной массы. Дорожка 2: Полностью очищенные мембраны, демонстрирующие значительное обогащение MP20 (20 кДа) и другими интегральными мембранными белками, включая MIP (26 кДа) и его продукт расщепления 22 кДа, а также MP38, который представляет собой форму расщепления коннексинов 46 и 50. Дорожка 3 и 4: Нерастворимые и растворимые фракции, соответственно, после обработки мембран DM. Дорожка 5 и 6: Растворимые белки, которые не связывались (в основном MP20), и белки, которые связывались с MonoQ, соответственно. Дорожка 7: Чистый MP20, элюированный из колонки для эксклюзионной хроматографии S-200. Дорожка 8: Иммуноблот дорожки 5, идентифицирующий MP20 и его димер, который не обнаруживается в окрашенном геле.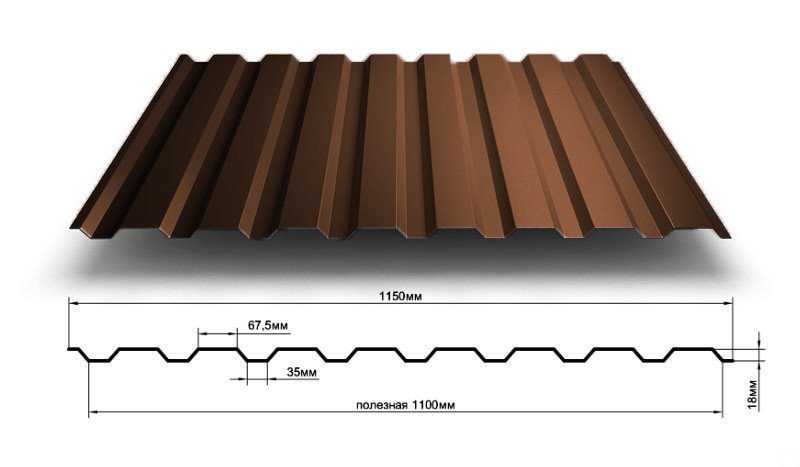 (B) Одноступенчатая очистка MP20 на колонке MonoQ. MP20 является единственным основным интегральным мембранным белком, который не связывается с колонкой при pH 8 (стрелка). (C) Эксклюзионная хроматография чистого MP20. Белок элюировали 15 мл. AU и mAU — единицы поглощения при 280 нм. (D) Калибровка колонки S-200. Vo = 8 мл. MP20 имеет кажущуюся молекулярную массу 60 кДа (стрелка).
(B) Одноступенчатая очистка MP20 на колонке MonoQ. MP20 является единственным основным интегральным мембранным белком, который не связывается с колонкой при pH 8 (стрелка). (C) Эксклюзионная хроматография чистого MP20. Белок элюировали 15 мл. AU и mAU — единицы поглощения при 280 нм. (D) Калибровка колонки S-200. Vo = 8 мл. MP20 имеет кажущуюся молекулярную массу 60 кДа (стрелка).
Изображение в полный размер
Очистку галектина-3 начинали с препаратов клеточных мембран из необработанных волокон, которые включали интегрированные в мембрану белки, упомянутые выше, и, кроме того, большое количество мембрано-адгезивных белков (рис. 3А, дорожка 2). На одном этапе щелочной экстракции было удалено достаточное количество галектина-3 для очистки вместе с переменными количествами других белков, связанных с мембраной (рис. 3А, дорожка 4). Присутствие галектина-3 в этой фракции было подтверждено иммуноблоттингом (рис. 3А, дорожка 7). Галектин-3 очищали с помощью аффинной хроматографии на колонке с α-лактозой и агарозой [27], используя сайт связывания лектина белка.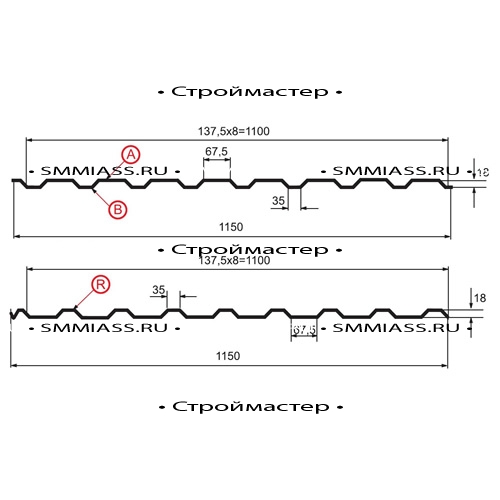 Единственный пик был элюирован 100 мМ лактозы (рис. 3B) и содержал исключительно галектин-3 с кажущейся молекулярной массой 31 кДа с помощью SDS-PAGE (рис. 3A, дорожка 5). Его идентичность была подтверждена иммуноблоттинговым анализом (фиг. 3А, дорожка 8). На колонке для гель-фильтрации (рис. 3C) галектин-3 элюировался при 12,5 мл (Vo = 8,3 мл) (рис. 3A, дорожка 6), что соответствует кажущейся молекулярной массе 22 кДа (рис. 3D), что меньше кажущейся молекулярной массы. на СТРАНИЦЕ паспортов безопасности. Это предполагает, что очищенный галектин-3 находится в (гидродинамически) компактной конформации и является мономерным.
Единственный пик был элюирован 100 мМ лактозы (рис. 3B) и содержал исключительно галектин-3 с кажущейся молекулярной массой 31 кДа с помощью SDS-PAGE (рис. 3A, дорожка 5). Его идентичность была подтверждена иммуноблоттинговым анализом (фиг. 3А, дорожка 8). На колонке для гель-фильтрации (рис. 3C) галектин-3 элюировался при 12,5 мл (Vo = 8,3 мл) (рис. 3A, дорожка 6), что соответствует кажущейся молекулярной массе 22 кДа (рис. 3D), что меньше кажущейся молекулярной массы. на СТРАНИЦЕ паспортов безопасности. Это предполагает, что очищенный галектин-3 находится в (гидродинамически) компактной конформации и является мономерным.
Очистка и характеристика галектина-3 хрусталика. (A) SDS-PAGE и документация по вестерн-блоттингу процесса очистки. Дорожка 1: Маркеры молекулярной массы. Дорожка 2: Необработанные клеточные мембраны волокон хрусталика. Дорожка 3 и 4: Нерастворимая и растворимая фракции соответственно после обработки 20 мМ NaOH. Дорожка 5: Чистый галектин-3, элюированный из колонки α-лактоза-агароза 100 мМ лактозы. Переулок 6: Галектин-3 элюировали из колонки для эксклюзионной хроматографии S-75. Дорожки 7 и 8: Иммуноблот препаратов на дорожках 4 и 5, идентифицирующий галектин-3. (B) Галектин-3 связан с колонкой α-лактоза-агароза и элюирован 100 мМ лактозы. (C) Эксклюзионная хроматография чистого галектина-3. Белок элюировали 12,5 мл. mAU относится к единицам поглощения при 280 нм (D). Калибровка колонки S-75. Vo = 8,3 мл. Галектин-3 имеет кажущуюся молекулярную массу 22 кДа (стрелка).
Дорожка 5: Чистый галектин-3, элюированный из колонки α-лактоза-агароза 100 мМ лактозы. Переулок 6: Галектин-3 элюировали из колонки для эксклюзионной хроматографии S-75. Дорожки 7 и 8: Иммуноблот препаратов на дорожках 4 и 5, идентифицирующий галектин-3. (B) Галектин-3 связан с колонкой α-лактоза-агароза и элюирован 100 мМ лактозы. (C) Эксклюзионная хроматография чистого галектина-3. Белок элюировали 12,5 мл. mAU относится к единицам поглощения при 280 нм (D). Калибровка колонки S-75. Vo = 8,3 мл. Галектин-3 имеет кажущуюся молекулярную массу 22 кДа (стрелка).
Изображение полного размера
In vitro и in vivo Комплексообразование между МП20 и галектином-3 Получив чистые препараты МП20 и галектина-3, исследовали их способность взаимодействовать друг с другом путем их смешивания и мониторинг образования комплекса, состоящего из обоих белков. Это было достигнуто с помощью гель-фильтрации смеси, которая должна либо показать пик для каждого белка в отдельности с заранее определенной молекулярной массой, что указывает на отсутствие взаимодействия, либо основной пик с более высокой молекулярной массой, содержащий оба белка, что указывает на положительное взаимодействие. При смешивании чистого MP20 (Фигура 4А, дорожка 2) и чистого галектина-3 (Фигура 4А, дорожка 3) с молярным соотношением 1:6 преобладающий пик элюировался при 13 мл (v o = 7,8 мл), что соответствует кажущейся молекулярной массе 104 кДа (фиг. 4В и 4С). SDS-PAGE выявил присутствие MP20 и галектина-3 (фиг. 4A, дорожка 4), причем последний выглядит как дублет из-за незначительного протеолиза. Такой протеолиз наблюдался ранее и, по-видимому, не отменял связывания [28]. Пик на правом краю фиг. 4В содержал несвязанный галектин-3, но свободного MP20 не наблюдалось. Когда аналогичный эксперимент был проведен с использованием молярного соотношения 1:2, профиль элюирования был аналогичен приведенному выше, за исключением того, что был получен дополнительный пик, который содержал исключительно MP20 (данные не показаны). Следовательно, необходимо было использовать избыток галектина-3 для насыщения всех MP20, что указывает на то, что не все галектин-3 сохранили способность связываться с MP20 или что очищенные MP20 и галектин-3 имеют умеренное сродство друг к другу.
При смешивании чистого MP20 (Фигура 4А, дорожка 2) и чистого галектина-3 (Фигура 4А, дорожка 3) с молярным соотношением 1:6 преобладающий пик элюировался при 13 мл (v o = 7,8 мл), что соответствует кажущейся молекулярной массе 104 кДа (фиг. 4В и 4С). SDS-PAGE выявил присутствие MP20 и галектина-3 (фиг. 4A, дорожка 4), причем последний выглядит как дублет из-за незначительного протеолиза. Такой протеолиз наблюдался ранее и, по-видимому, не отменял связывания [28]. Пик на правом краю фиг. 4В содержал несвязанный галектин-3, но свободного MP20 не наблюдалось. Когда аналогичный эксперимент был проведен с использованием молярного соотношения 1:2, профиль элюирования был аналогичен приведенному выше, за исключением того, что был получен дополнительный пик, который содержал исключительно MP20 (данные не показаны). Следовательно, необходимо было использовать избыток галектина-3 для насыщения всех MP20, что указывает на то, что не все галектин-3 сохранили способность связываться с MP20 или что очищенные MP20 и галектин-3 имеют умеренное сродство друг к другу. Тем не менее данные подтверждают, что галектин-3 является лигандом MP20 и что два белка могут образовывать комплекс in vitro .
Тем не менее данные подтверждают, что галектин-3 является лигандом MP20 и что два белка могут образовывать комплекс in vitro .
Комплексообразование MP20/галектин-3 in vitro . (A) SDS-PAGE анализ чистого MP20 и чистого галектина-3 и образовавшегося комплекса. Переулок 1 . Маркеры молекулярного веса. Полосы 2 и 3 . Чистый MP20 и галектин-3 использовали для эксперимента по связыванию соответственно. Переулок 4 . Комплекс элюируют с колонки для гель-фильтрации. Галектин-3 появляется как дублет из-за незначительного протеолиза [28]. (B) Эксклюзионная хроматография комплексов MP20/галектин-3, образовавшихся после смешивания очищенной линзы MP20 с очищенным галектином-3. Комплекс элюировался при 13 мл. mAU относится к единицам поглощения при 280 нм. (C) Калибровка колонки S-200. В о = 7,8 мл. Комплекс MP20/галектин-3 имеет кажущуюся молекулярную массу 104 кДа (стрелка).
Изображение с полным размером
Эта способность MP20 и галектина-3 связываться друг с другом была дополнительно подтверждена вторым протоколом, направленным на очистку нативных комплексов MP20/галектин-3 непосредственно из волокнистых клеточных мембран. Начиная с «частично очищенных» мембран, которые все еще содержали некоторое количество галектина-3 (рис. 5А, дорожка 2), MP20 неизменно совместно очищался с галектином-3 на колонке MonoQ (стрелка на рис. 5В; 5А, дорожка 3). Гель-фильтрация этой фракции (указана стрелкой на рис. 5В) дала один пик с элюированием 13,8 мл (vo = 8 мл), что соответствует кажущейся молекулярной массе 102 кДа (рис. 5С и 5D) и содержит оба белка (дорожки на рис. 5А). 5–7). Это убедительно указывает на то, что галектин-3 и MP20 также взаимодействуют друг с другом in vivo .
Рисунок 5 Очистка нативного комплекса MP20/галектин-3 от мембран хрусталика и роль лектинового сайта. (A) SDS-PAGE и документация по вестерн-блоттингу процесса очистки. Дорожка 1: Маркеры молекулярной массы. Дорожка 2 : Частично удаленные клеточные мембраны волокон хрусталика, показывающие как галектин-3, так и обогащенный MP20. Дорожки 3 и 4: Белки, которые не связались (включая MP20 и галектин-3), и белки, которые связались с колонкой MonoQ, соответственно. Дорожка 5: MP20 и галектин-3 элюировали из колонки S-200. Дорожки 6 и 7: Иммуноблоты дорожки 5, идентифицирующие MP20 и галектин-3 соответственно. Обратите внимание, что анти-MP20 также распознает димерные MP20, которые обычно не обнаруживаются на окрашенных гелях. (B) Галектин-3 и MP20 не связывались с колонкой при pH 8 (стрелка). (C) Эксклюзионная хроматография комплекса. Один пик элюировался с колонки S-200 при 13,8 мл. AU относится к единицам поглощения при 280 нм. (D) Калибровка колонки S-200 м. Vo = 8 мл. Комплекс MP20/галектин-3 имеет кажущуюся молекулярную массу 102 кДа (стрелка). (E) Иммунопреципитация MP20 и галектина-3 и обнаружение белка вестерн-блоттингом.
Дорожка 1: Маркеры молекулярной массы. Дорожка 2 : Частично удаленные клеточные мембраны волокон хрусталика, показывающие как галектин-3, так и обогащенный MP20. Дорожки 3 и 4: Белки, которые не связались (включая MP20 и галектин-3), и белки, которые связались с колонкой MonoQ, соответственно. Дорожка 5: MP20 и галектин-3 элюировали из колонки S-200. Дорожки 6 и 7: Иммуноблоты дорожки 5, идентифицирующие MP20 и галектин-3 соответственно. Обратите внимание, что анти-MP20 также распознает димерные MP20, которые обычно не обнаруживаются на окрашенных гелях. (B) Галектин-3 и MP20 не связывались с колонкой при pH 8 (стрелка). (C) Эксклюзионная хроматография комплекса. Один пик элюировался с колонки S-200 при 13,8 мл. AU относится к единицам поглощения при 280 нм. (D) Калибровка колонки S-200 м. Vo = 8 мл. Комплекс MP20/галектин-3 имеет кажущуюся молекулярную массу 102 кДа (стрелка). (E) Иммунопреципитация MP20 и галектина-3 и обнаружение белка вестерн-блоттингом.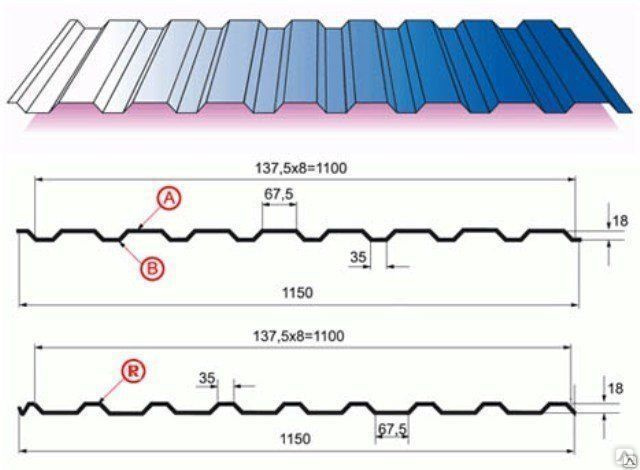 Дорожки 1 и 2: галектина-3, обнаруженного без и с присутствием лактозы, соответственно. Обратите внимание на удаление галектина-3 из комплекса в присутствии лактозы. Дорожки 3 и 4: Обнаружены равные количества MP20 без и с присутствием лактозы, соответственно.
Дорожки 1 и 2: галектина-3, обнаруженного без и с присутствием лактозы, соответственно. Обратите внимание на удаление галектина-3 из комплекса в присутствии лактозы. Дорожки 3 и 4: Обнаружены равные количества MP20 без и с присутствием лактозы, соответственно.
Изображение полного размера
Лектиновый сайт галектина-3, по-видимому, участвует в связывании с MP20
Поскольку ранее было показано, что галектин-3 связывает другие белковые лиганды через свой лектиновый домен или другие сегменты молекулы [21] , взаимодействие между MP20 и galectin-3 было дополнительно проанализировано, чтобы различить эти две возможности. Нативные комплексы MP20/галектин-3 сначала солюбилизировали из неочищенных мембран, а затем участие лектинового сайта исследовали с помощью иммунопреципитации с анти-MP20 и белком А-сефарозными шариками в отсутствие или в присутствии 100 мМ лактозы, которая конкурирует за лектиновый сайт. . В отсутствие лактозы галектин-3 осаждался совместно с MP20, как и ожидалось (рис.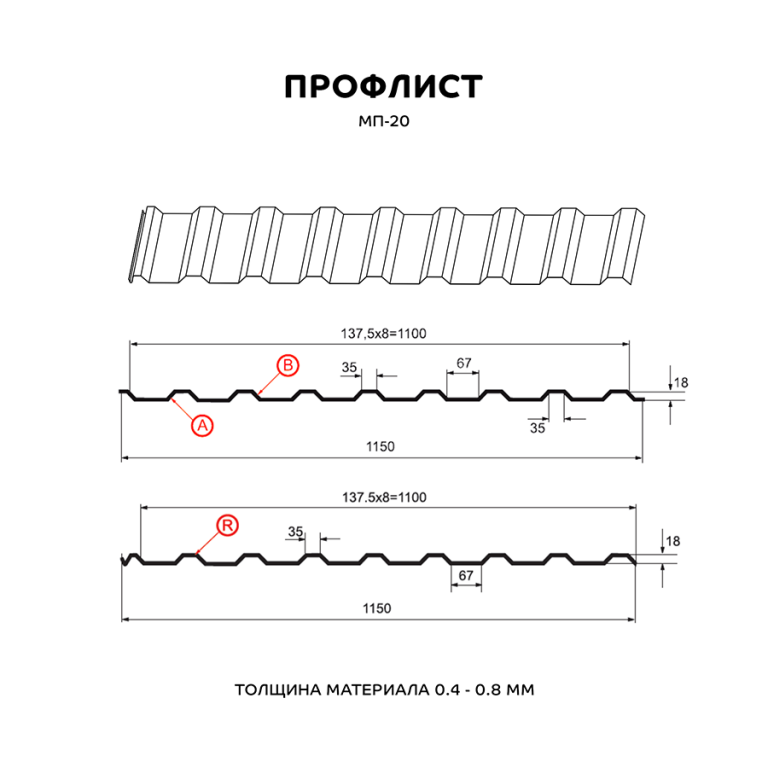 5E, дорожки 1 и 3). Однако в присутствии 100 мМ лактозы большая часть галектина-3 удалялась из нативных комплексов, оставляя только MP20 (рис. 5E, дорожки 2 и 4). Лактоза не влияла на связывание MP20 с гранулами сефарозы белка А, так как равные количества MP20 связывались с гранулами независимо от того, присутствовала лактоза или нет (Фигура 5E, дорожки 3 и 4). Этот результат предполагает, что галектин-3 связывается с MP20 через свой лектиновый сайт.
5E, дорожки 1 и 3). Однако в присутствии 100 мМ лактозы большая часть галектина-3 удалялась из нативных комплексов, оставляя только MP20 (рис. 5E, дорожки 2 и 4). Лактоза не влияла на связывание MP20 с гранулами сефарозы белка А, так как равные количества MP20 связывались с гранулами независимо от того, присутствовала лактоза или нет (Фигура 5E, дорожки 3 и 4). Этот результат предполагает, что галектин-3 связывается с MP20 через свой лектиновый сайт.
Обсуждение
Взаимодействие между галектином-3 и членом суперсемейства тетраспанинов кажется новым. Недавний список лигандов для galectin-3 включает множество белков мембраны и внеклеточного матрикса, но ни один из этих белков не принимает топологию tetraspanin [29]. Однако известно, что многие лиганды галектина-3 участвуют в адгезии. Эта особенность характерна для MP20, который, как сообщается, формирует мембранные соединения между волокнистыми клетками хрусталика [15–17]. Следовательно, в то время как MP20 может быть первым из нового класса лигандов galectin-3, он легко вписывается в формирующийся паттерн функции лиганда.
Представленные здесь доказательства, подтверждающие специфическое связывание галектина-3 и MP20, основаны на следующих наблюдениях: (1) MP20 и галектин-3 совместно локализуются в выбранных областях мембран хрусталика; (2) чистый MP20 и галектин-3 спонтанно восстанавливаются в комплекс 104 кДа при смешивании; (3) MP20 постоянно совместно очищается от сырых мембран в виде комплекса 102 кДа с галектином-3; 4) ранее наблюдалась совместная очистка после анионообменной хроматографии МР20 с белком 31 кДа, хотя последний не комментировался и оставался неидентифицированным [26]. Все четыре наблюдения согласуются друг с другом и однозначно идентифицируют MP20 как нового члена среди лигандов галектина-3.
Стехиометрия комплекса MP20/галектин-3 остается несколько неопределенной, главным образом потому, что неизвестно, какое количество детергента связано с очищенным MP20. Кажущаяся молекулярная масса 60 кДа позволяет получить тример без связанного детергента или димер со значительным количеством связанного детергента. Для сравнения, солюбилизированный детергентом основной внутренний белок мембраны клеток волокон хрусталика с молекулярной массой 26 кДа, MIP, имеет значительное количество связанного детергента. Сообщается, что молекулярная масса солюбилизированного детергентом MIP находится в диапазоне от 147 до 229 кДа.кДа [30–32]. Из электронной микроскопии мы знаем, что MIP, солюбилизированный детергентом, представляет собой тетрамер, следовательно, молекулярная масса одного белка составляет всего 104 кДа, разница заключается в детергенте [31]. Используя эту аналогию, димерная конформация для MP20 явно кажется более вероятной. Учитывая, что существует только один потенциальный сайт гликозилирования на мономер MP20 [14], можно ожидать, что две молекулы галектина-3 могут связываться с димером MP20. Увеличение молекулярной массы с 60 кДа до 104 кДа при добавлении очищенного галектина-3 согласуется с этой стехиометрией.
Для сравнения, солюбилизированный детергентом основной внутренний белок мембраны клеток волокон хрусталика с молекулярной массой 26 кДа, MIP, имеет значительное количество связанного детергента. Сообщается, что молекулярная масса солюбилизированного детергентом MIP находится в диапазоне от 147 до 229 кДа.кДа [30–32]. Из электронной микроскопии мы знаем, что MIP, солюбилизированный детергентом, представляет собой тетрамер, следовательно, молекулярная масса одного белка составляет всего 104 кДа, разница заключается в детергенте [31]. Используя эту аналогию, димерная конформация для MP20 явно кажется более вероятной. Учитывая, что существует только один потенциальный сайт гликозилирования на мономер MP20 [14], можно ожидать, что две молекулы галектина-3 могут связываться с димером MP20. Увеличение молекулярной массы с 60 кДа до 104 кДа при добавлении очищенного галектина-3 согласуется с этой стехиометрией.
Наблюдение, что лактоза эффективно высвобождает галектин-3 из изолированных нативных комплексов MP20, убедительно указывает на участие лектинового сайта во взаимодействии связывания. Это также предполагает, что MP20 является гликопротеином. MP20 имеет один консенсусный сайт гликозилирования, однако нам до сих пор не удалось продемонстрировать присутствие углеводов, несмотря на использование различных методов биохимического обнаружения (данные не показаны). Возможно, используемые наборы были недостаточно чувствительными или количество углеводов в MP20 очень мало. Для обнаружения таких более мелких углеводных фрагментов потребуется более тщательное исследование с использованием масс-спектрометрии.
Это также предполагает, что MP20 является гликопротеином. MP20 имеет один консенсусный сайт гликозилирования, однако нам до сих пор не удалось продемонстрировать присутствие углеводов, несмотря на использование различных методов биохимического обнаружения (данные не показаны). Возможно, используемые наборы были недостаточно чувствительными или количество углеводов в MP20 очень мало. Для обнаружения таких более мелких углеводных фрагментов потребуется более тщательное исследование с использованием масс-спектрометрии.
Какую роль может играть комплекс MP20/галектин-3 в хрусталике? Единственная точечная мутация в гене MP20 мыши To3 приводит к полному помутнению хрусталика и микрофтальму [18]. Хрусталик вакуолизирован, волокнистые клетки сильно дезорганизованы. Это говорит о том, что MP20 играет роль в разработке линз. Эта точка зрения подтверждается нашими результатами иммуномаркировки, которые показывают, что MP20 встраивается в мембрану в определенный момент созревания волокнистых клеток. Возможно, что galectin-3 играет критическую роль в модулировании способности MP20 образовывать адгезивные соединения на этой критической стадии развития. Такая модулирующая функция галектина-3 ранее была предложена на основании доказательств того, что его присутствие может увеличивать или уменьшать клеточную адгезию в других системах и что его секреция регулируется в процессе развития [21, 29].]. Остается установить для линзы MP20, требуется ли взаимодействие с галектином-3 для образования соединения или он противодействует этому процессу.
Возможно, что galectin-3 играет критическую роль в модулировании способности MP20 образовывать адгезивные соединения на этой критической стадии развития. Такая модулирующая функция галектина-3 ранее была предложена на основании доказательств того, что его присутствие может увеличивать или уменьшать клеточную адгезию в других системах и что его секреция регулируется в процессе развития [21, 29].]. Остается установить для линзы MP20, требуется ли взаимодействие с галектином-3 для образования соединения или он противодействует этому процессу.
Таким образом, основной белок мембраны хрусталика MP20 является новым членом в списке лигандов галектина-3. MP20 принадлежит к надсемейству тетраспанинов, которые имеют разнообразные функции клеточной поверхности, связанные с пролиферацией, дифференцировкой, миграцией и адгезией. По-видимому, эти функции дополняют функции галектина-3 как модулятора адгезии. Следовательно, может быть целесообразно проверить другие тетраспанины на их способность связывать галектин-3.
Материалы и методы
Иммуноцитохимия
Линзы крыс фиксировали в 0,75% параформальдегиде в фосфатно-солевом буфере (PBS) в течение 24 часов при комнатной температуре. Их промывали 3 раза по 10 мин в PBS, затем подвергали криозащите путем инкубации в 10%-ном растворе сахарозы в PBS в течение 1 часа при комнатной температуре, затем в 20%-ном растворе сахарозы в PBS, а затем в 30%-ном растворе сахарозы в PBS при 4°C в течение ночи. Линзы были установлены в Tissue-Tek O.C.T. смесь при 4°C на предварительно охлажденных патронах. Патроны погружали в жидкий азот на 25 с, чтобы заморозить линзы, а затем хранили на сухом льду. Криосрезы толщиной 10 мкм делали при температуре -18°C на криостате (Leica CM3050) и помещали на предметные стекла, покрытые поли-L-лизином. Все последующие процедуры проводили либо при комнатной температуре в течение указанного времени, либо при 4°С в течение ночи во влажном боксе. Предметные стекла промывали PBS и обрабатывали в течение 1 часа блокирующим раствором (3% бычий сывороточный альбумин, 3% фетальной телячьей сыворотки в PBS), промывали 3 раза по 5 минут в PBS и обрабатывали в течение 2 часов мышиным моноклональным анти-галектином. 3 (Affinity Bioregents Inc. [24]) и кроличьи анти-MP20 [17], разбавленные 1:25 и 1:100 соответственно в блокирующем растворе. Предметные стекла промывали в PBS для удаления несвязавшихся антител и инкубировали в течение 1,5 ч в темноте с разбавленными 1:200 антикроличьими и антимышиными иммуноглобулинами, конъюгированными с Alexa Fluor 488 и 568, соответственно (Molecular Probes). После промывки в PBS ядра клеток окрашивали йодидом пропидия (0,2% в PBS) в течение 5 мин, предметные стекла промывали и заключали в 10 мкл Citifluor AF1. Изображения каждого шаблона окрашивания хромофора записывали в цифровом виде с использованием лазерного сканирующего конфокального микроскопа (Leica TCS 4D), затем псевдоцветили и объединяли с помощью программного обеспечения Adobe Photoshop.
3 (Affinity Bioregents Inc. [24]) и кроличьи анти-MP20 [17], разбавленные 1:25 и 1:100 соответственно в блокирующем растворе. Предметные стекла промывали в PBS для удаления несвязавшихся антител и инкубировали в течение 1,5 ч в темноте с разбавленными 1:200 антикроличьими и антимышиными иммуноглобулинами, конъюгированными с Alexa Fluor 488 и 568, соответственно (Molecular Probes). После промывки в PBS ядра клеток окрашивали йодидом пропидия (0,2% в PBS) в течение 5 мин, предметные стекла промывали и заключали в 10 мкл Citifluor AF1. Изображения каждого шаблона окрашивания хромофора записывали в цифровом виде с использованием лазерного сканирующего конфокального микроскопа (Leica TCS 4D), затем псевдоцветили и объединяли с помощью программного обеспечения Adobe Photoshop.
Подготовка клеточных мембран волокон хрусталика
Для изучения связывания MP20 и галектина-3 белки очищали из мембран хрусталиков овец. Были изготовлены три различных препарата мембран. Все процедуры проводили при 4°C, если не указано иное. После удаления капсулы и эпителия партии из 100 линз гомогенизировали в 100 мл 5 мМ Tris-HCl pH 8,0, 5 мМ EDTA и 5 мМ EGTA. Мембраны осаждали при 18000 г в течение 20 мин, а затем дважды промывали в том же буфере. Этот препарат получил название «грубые мембраны». Прилипшие к мембране кристаллины и белки цитоскелета удаляли из неочищенных мембран с помощью мочевино-щелочной десорбции [25]. В одном протоколе мембранно-адгезивные белки удалялись лишь частично; Неочищенный препарат мембраны центрифугировали и осадок ресуспендировали в 15 мл 4 М мочевины, 5 мМ трис-HCl, рН 9..5, 5 мМ ЭДТА, 5 мМ ЭГТА. После центрифугирования при 110000 g в течение 40 мин осадок дважды промывали в 15 мл 20 мМ NaOH и, наконец, ресуспендировали в буфере для хранения, содержащем 5 мМ Трис-HCl, рН 8,0, 2 мМ ЭДТА, 2 мМ ЭГТА. Полученные мембраны были помечены как «частично очищенные мембраны», поскольку они содержали интегрированные в мембрану белки, а также некоторые из более прочно связанных белков периферических мембран, включая галектин-3.
После удаления капсулы и эпителия партии из 100 линз гомогенизировали в 100 мл 5 мМ Tris-HCl pH 8,0, 5 мМ EDTA и 5 мМ EGTA. Мембраны осаждали при 18000 г в течение 20 мин, а затем дважды промывали в том же буфере. Этот препарат получил название «грубые мембраны». Прилипшие к мембране кристаллины и белки цитоскелета удаляли из неочищенных мембран с помощью мочевино-щелочной десорбции [25]. В одном протоколе мембранно-адгезивные белки удалялись лишь частично; Неочищенный препарат мембраны центрифугировали и осадок ресуспендировали в 15 мл 4 М мочевины, 5 мМ трис-HCl, рН 9..5, 5 мМ ЭДТА, 5 мМ ЭГТА. После центрифугирования при 110000 g в течение 40 мин осадок дважды промывали в 15 мл 20 мМ NaOH и, наконец, ресуспендировали в буфере для хранения, содержащем 5 мМ Трис-HCl, рН 8,0, 2 мМ ЭДТА, 2 мМ ЭГТА. Полученные мембраны были помечены как «частично очищенные мембраны», поскольку они содержали интегрированные в мембрану белки, а также некоторые из более прочно связанных белков периферических мембран, включая галектин-3. Их хранили при -20°С при концентрации белка примерно 4 мг/мл. Концентрации белка определяли с использованием метода анализа белка ВСА (Pierce).
Их хранили при -20°С при концентрации белка примерно 4 мг/мл. Концентрации белка определяли с использованием метода анализа белка ВСА (Pierce).
«Полностью очищенные мембраны» также получали из препаратов неочищенных мембран в соответствии с процедурой, аналогичной описанной выше, но с использованием больших количеств мочевины и щелочных растворов и добавлением стадии экстракции лактозы для удаления любого оставшегося галектина-3. Препараты полностью очищенных мембран содержали только интегрированные в мембрану белки. Неочищенный препарат мембраны центрифугировали и осадок ресуспендировали в 100 мл 4 М мочевины, 5 мМ трис-HCl, рН 9,5, 5 мМ ЭДТА, 5 мМ ЭГТА. Мембраны осаждали при 140000 г в течение 1 часа и затем трижды промывали в 100 мл 20 мМ NaOH. Затем мембраны инкубировали в 100 мМ лактозе в буфере для хранения в течение 10 мин при комнатной температуре и осаждали, как описано выше. Стадию с лактозой повторяли один раз, и полностью очищенные мембраны ресуспендировали в буфере для хранения и хранили при -20°C при концентрации белка примерно 1,5 мг/мл до дальнейшего использования.
Очистка MP20
MP20 очищали с помощью одной стадии ионообменной хроматографии. Аликвоты полностью очищенных мембран солюбилизировали в 1% н-децил-бета-D-мальтопиранозиде (DM) (Sigma Chemical Co) в буфере для хранения при комнатной температуре. Нерастворимый материал осаждали при 110000 г в течение 1 часа. Растворимые белки разделяли на колонке MonoQ (Pharmacia Biotech), уравновешенной 0,3% DM в буфере для хранения, на AKTA FPLC (Pharmacia Biotech). Все белки, кроме MP20, связывались с колонкой. МП20 в проточной фракции концентрировали патронами Центрикон-10 по мере необходимости. MP20 анализировали эксклюзионной хроматографией с использованием колонки S-200 10/30 (Pharmacia Biotech), уравновешенной 0,3% DM, 0,5 М NaCl в буфере для хранения. Колонку калибровали с использованием овальбумина, бычьего сывороточного альбумина (БСА), альдолазы, химотрипсиногена А и рибонуклеазы А в качестве белков-маркеров и синего декстрана для определения объема пустот колонки. Для расчета молекулярной массы калибровочный график log Mw против . Кав был построен. Kav = (Vc-Vo/Vt-Vo), где Vc = объем элюции белка, Vt = объем колонки (24 мл) и Vo = пустой объем колонки.
Кав был построен. Kav = (Vc-Vo/Vt-Vo), где Vc = объем элюции белка, Vt = объем колонки (24 мл) и Vo = пустой объем колонки.
Очистка галектина-3
Для растворения достаточного количества галектина-3 для дальнейшей очистки использовали одну стадию обработки сырых мембран 20 мМ NaOH. Нерастворимый материал осаждали при 140000 г в течение 1 часа и супернатант подвергали диализу против 2 л 50 мМ HEPES, pH 6,8, 2 мМ ЭДТА, 2 мМ EGTA, при комнатной температуре в течение 24 часов. Затем супернатант наносили на колонку с альфа-лактозой и агарозой (Sigma), предварительно уравновешенную 10 мМ HEPES, pH 6,8, 150 мМ NaCl, 2 мМ ЭДТА, 2 мМ EGTA, и элюировали 100 мМ лактозой в том же буфере. Чистый галектин-3 получали на этой единственной стадии очистки и далее анализировали эксклюзионной хроматографией с использованием колонки S-75 10/30 (Pharmacia Biotech), уравновешенной тем же буфером. Колонку калибровали с использованием рибонуклеазы А, химотрипсиногена А, овальбумина и БСА в качестве белков-маркеров и синего декстрана для определения объема пустот.
Выделение комплексов, содержащих МП20 и галектин-3
Способность МП20 и галектина-3 взаимодействовать друг с другом исследовали двумя способами: во-первых, путем анализа комплекса, образующегося при объединении очищенных белков, и во-вторых, путем определения можно ли выделить подобный комплекс из клеточных мембран волокон хрусталика. Протокол для первого подхода был следующим. Лактозу удаляли из очищенного галектина-3 путем диализа против 2 л 10 мМ Трис-HCl, рН 8,0, 2 мМ ЭДТА, 2 мМ ЭГТА при комнатной температуре в течение 24 часов. Затем галектин-3 инкубировали с очищенным MP20 в течение 24 часов при 4°C в молярном соотношении 6:1. Смесь анализировали эксклюзионной хроматографией с использованием колонки S-200 10/30 (Pharmacia Biotech), уравновешенной 0,3% DM, 0,5 М NaCl в буфере для хранения. Колонку калибровали с использованием альдолазы, БСА, овальбумина и химотрипсиногена А в качестве белков-маркеров и синего декстрана для определения объема пустот колонки.
Альтернативно, нативный комплекс MP20 и галектина-3 был выделен из клеточных мембран волокон хрусталика. Для этого использовали тот же протокол, что и для очистки MP20, за исключением того, что в качестве исходного материала использовали «частично очищенные» мембраны. Выделенные комплексы MP20/галектин-3 анализировали с помощью гель-фильтрации, как указано выше, с использованием карбоангидразы, БСА, алкогольдегидрогеназы и синего декстрана для калибровки.
Для этого использовали тот же протокол, что и для очистки MP20, за исключением того, что в качестве исходного материала использовали «частично очищенные» мембраны. Выделенные комплексы MP20/галектин-3 анализировали с помощью гель-фильтрации, как указано выше, с использованием карбоангидразы, БСА, алкогольдегидрогеназы и синего декстрана для калибровки.
Изучение взаимодействия между галектином-3 и MP20
Комплексы MP20 и галектина-3 сначала солюбилизировали из неочищенных мембран, а растворимые комплексы обрабатывали лактозой, чтобы определить, разделяет ли это два белка. Неочищенные мембраны обрабатывали 1% DM в 10 мМ HEPES pH 6,8, 2 мМ EDTA, 2 мМ EGTA в течение 1 часа при комнатной температуре и собирали растворимый материал после центрифугирования при 140000 g в течение 1 часа. Затем растворимые белки инкубировали в течение 1 часа с анти-MP20 в разведении 1:50 в 10 мМ HEPES, pH 6,8, 2 мМ EDTA, 2 мМ EGTA, 0,3% DM. Три объема раствора, содержащего 50% гранул сефарозы протеина А, 10 мМ HEPES pH 6,8, 2 мМ ЭДТА, 2 мМ ЭГТА, 100 мМ NaCl, 0,3% DM и либо отсутствие, либо 100 мМ лактозы, добавляли к иммунопреципитированному MP20/ комплексов галектина-3 и инкубировали в течение ночи при комнатной температуре.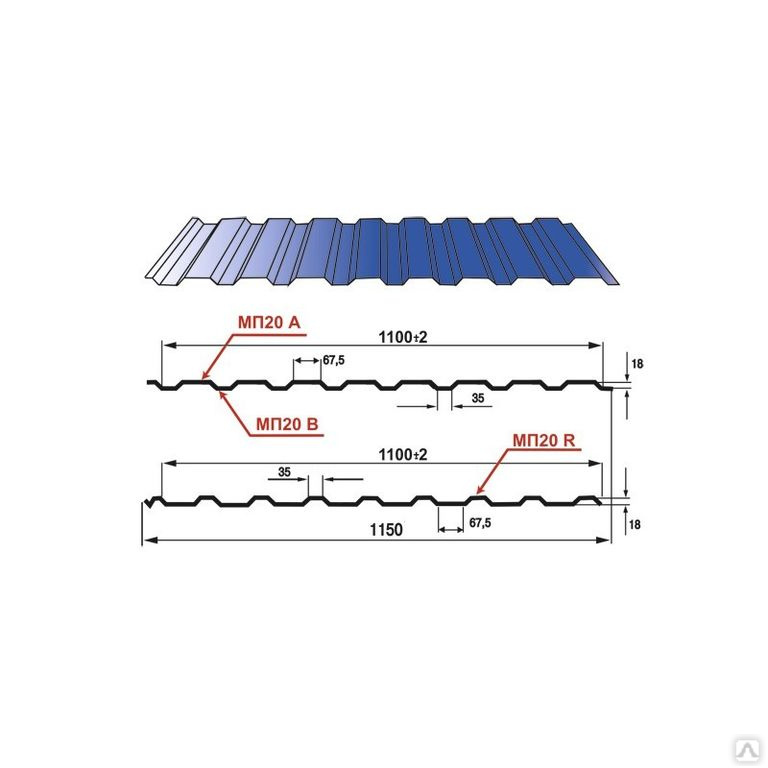 Гранулы несколько раз промывали соответствующими буферами (с лактозой или без нее), собирали центрифугированием и анализировали методом иммуноблоттинга. Для этой цели 17,5% акриламидные гели запускали в ячейке Mini-PROTEAN II (BIO-RAD). Белки солюбилизировали в буфере для образцов без кипячения, поскольку нагревание приводило к агрегации некоторых интегральных белков мембраны. Белки визуализировали окрашиванием серебром. Для иммуноблоттинга белки переносили электрофоретически в ячейку Mini-PROTEAN Trans-Blot (BIO-RAD) на чистые нитроцеллюлозные мембраны Hybond-C (Amersham LIFE SCIENCES). Блоты окрашивали раствором 0,1% Ponceau S/1% уксусной кислоты для визуализации и регистрации положения белков хрусталика и маркеров молекулярной массы. После промывания в воде milliQ блоты блокировали в течение ночи при 4°C в 5% сухом обезжиренном молоке в трис-буферном солевом растворе (TBS). Блоты инкубировали либо с анти-галектином-3 (1:200 в TBS, содержащем 1% BSA), либо с анти-MP20 (1:1000), и связанные антитела выявляли с помощью биотинилированных вторичных антител при 1:1000 и стрептавидин-пероксидазы хрена при 1: 1000 в соответствии с инструкциями производителя (ECL, Amersham LIFE SCIENCES).
Гранулы несколько раз промывали соответствующими буферами (с лактозой или без нее), собирали центрифугированием и анализировали методом иммуноблоттинга. Для этой цели 17,5% акриламидные гели запускали в ячейке Mini-PROTEAN II (BIO-RAD). Белки солюбилизировали в буфере для образцов без кипячения, поскольку нагревание приводило к агрегации некоторых интегральных белков мембраны. Белки визуализировали окрашиванием серебром. Для иммуноблоттинга белки переносили электрофоретически в ячейку Mini-PROTEAN Trans-Blot (BIO-RAD) на чистые нитроцеллюлозные мембраны Hybond-C (Amersham LIFE SCIENCES). Блоты окрашивали раствором 0,1% Ponceau S/1% уксусной кислоты для визуализации и регистрации положения белков хрусталика и маркеров молекулярной массы. После промывания в воде milliQ блоты блокировали в течение ночи при 4°C в 5% сухом обезжиренном молоке в трис-буферном солевом растворе (TBS). Блоты инкубировали либо с анти-галектином-3 (1:200 в TBS, содержащем 1% BSA), либо с анти-MP20 (1:1000), и связанные антитела выявляли с помощью биотинилированных вторичных антител при 1:1000 и стрептавидин-пероксидазы хрена при 1: 1000 в соответствии с инструкциями производителя (ECL, Amersham LIFE SCIENCES).
Сокращения
- DM:
н-децил-бета-D-мальтопиранозид
- ТБС:
Трис буферный физиологический раствор
- ПБС:
фосфатно-солевой буфер
- БСА:
бычий сывороточный альбумин
- SDS-СТРАНИЦА:
- Электрофорез в полиакриламидном геле с додецилсульфатом натрия
.
Ссылки
Maecker HT, Todd SC, Levy S: Надсемейство тетраспанинов – молекулярные посредники. FASEB J. 1997, 11: 428-442.
КАС пабмед Google ученый
Horejsi V, Vlcek C: Новое структурно отличное семейство поверхностных гликопротеинов лейкоцитов, включая CD9, CD37, CD53 и CD63.
 ФЭБС лат. 1991, 288: 1-4. 10.1016/0014-5793(91)80988-Ф.
ФЭБС лат. 1991, 288: 1-4. 10.1016/0014-5793(91)80988-Ф.КАС Статья пабмед Google ученый
Tachibana I, Hemler ME: Роль трансмембранных белков суперсемейства 4 (TM4SF) CD9 и CD81 в слиянии мышечных клеток и поддержании мышечных трубок. Дж. Клеточная биология. 1999, 146: 893-904. 10.1083/jcb.146.4.893.
Центральный пабмед КАС Статья пабмед Google ученый
Serru V, Naour FLe, Billard M, Azorsa DO, Lanza F, Boucheix C, Rubenstein E: селективные комплексы тетраспан-интегрин (CD81/альфа 4 бета 1, CD151/альфа 3 бета 1, CD151/альфа6 бета 1 ) в условиях, нарушающих тетраспановые взаимодействия. Биохим. Дж. 1999, 340: 103-111. 10.1042/0264-6021:3400103.
Центральный пабмед КАС пабмед Google ученый
Nakamura K, Iwamoto R, Mekada E: Заякоренный в мембране гепарин, связывающий EGF-подобный фактор роста (Hb-EGF) и белок, ассоциированный с рецептором токсина дифтерии (DRAP27)/CD9образуют комплекс с интегрином α3β1 в местах межклеточных контактов.
 Дж. Клеточная биология. 1995, 129: 1691-1705.
Дж. Клеточная биология. 1995, 129: 1691-1705.КАС Статья пабмед Google ученый
Нермут М.В., Исон П., Херст Р., Келли С.: Адгезия клеточного субстрата в крысиных фибробластах, трансформированных RSV. Эксп. Сотовый рез. 1991, 193: 382-397.
КАС Статья пабмед Google ученый
Taylor V, Suter U: Эпителиальный мембранный белок-2 и эпителиальный мембранный белок-3 – два новых члена семейства генов периферического миелинового белка 22. Ген. 1996, 175: 115-120. 10.1016/0378-1119(96)00134-5.
КАС Статья пабмед Google ученый
Brancolini C, Marzinotto S, Schneider C: Восприимчивость к P53-зависимому апоптозу коррелирует с повышенным уровнем белков GAS2 и GAS3. Смерть клеток 1997, 4: 247-253. 10.1038/sj/cdd/440023210.1038/sj.
 cdd.4400232.
cdd.4400232.КАС Статья пабмед Google ученый
Spreyer P, Kuhn G, Hanemann CO, Gillen C, Schaal H, Kuhn R, Lemke G, Muller HW: Экспрессия транскрипта шванновских клеток, регулируемая аксоном, гомологична гену, специфичному для остановки роста. EMBO J. 1991, 10: 3661-3668.
Центральный пабмед КАС пабмед Google ученый
Zoidl G, Blass-Kampann S, D’Urso D, Schmalenbach C, Muller HM: Опосредованный ретровирусами перенос гена периферического миелинового белка PMP22 в шванновских клетках: модуляция клеточного роста. EMBO J. 1995, 14: 1122-1128.
Центральный пабмед КАС пабмед Google ученый
Brancolini C, Marzinotto S, Edomi P, Agostoni E, Fioretini C, Muller HW, Schneider C: Rho-зависимая регуляция распространения клеток с помощью тетраспанового мембранного белка Gas3/PMP22.
 Мол. биол. Клетка. 1999, 10: 2441-2459.
Мол. биол. Клетка. 1999, 10: 2441-2459.Центральный пабмед КАС Статья пабмед Google ученый
Adlkofer K, Martini R, Aguzzi A, Zielasek J, Tokya KV, Suter U: Гипермиелинизация и демиелинизирующая периферическая невропатия у мышей с дефицитом PMP22. Нац. Жене. 1995, 11: 274-280.
КАС Статья пабмед Google ученый
Mulders JWM, Voorter CEM, Lamers C, de Haard-Hoekman WA, Montecucco C, van de Ven WJM, Bloemendal H, de Jong WW: Клонирование и экспрессия основного белка мембраны хрусталика крысы, MP20. Курс. Глаз Res. 1988, 7: 207-219.
КАС Статья пабмед Google ученый
Кумар Н.М., Джарвис Л.Дж., Тенбрук Э., Луис С.Ф.: MP17, специфичный для волокна белок внутренней мембраны хрусталика глаза млекопитающих. Эксп.
 Глаз Res. 1993, 56: 35-43. 10.1006/упр.1993.1006.
Глаз Res. 1993, 56: 35-43. 10.1006/упр.1993.1006.КАС Статья пабмед Google ученый
Louis CF, Hur KC, Galvan AC, Tenbroek EM, Jarvis LJ, Eccleston ED, Howard JB: Идентификация белка массой 18 000 дальтон в клеточных мембранах волокон хрусталика млекопитающих. Дж. Биол. хим. 1989, 264: 19967-19973.
КАС пабмед Google ученый
Тенбрук Э., Арнесон М., Джарвис Л., Луис С. Распределение белка внутренней мембраны волокнистых клеток MP20 и коннексина 46 в хрусталике быка. Дж. Клеточные науки. 1992, 103: 245-257.
КАС пабмед Google ученый
Arneson ML, Louis CF: Структурное расположение белка плазматической мембраны клеток волокон хрусталика MP20. Эксп. Глаз Res. 1998, 66: 495-509. 10.1006/упр.1998.0477.
КАС Статья пабмед Google ученый
«>Чжоу Л., Ли Х, Чёрч Р.Л.: Белок внутренней мембраны волокнистых клеток мышей MP19ген ( Lim2 ) и белок мембраны гранулы ген GMP-17 ( Nkg7 ): выделение и анализ последовательности двух соседних генов. Мол. Вис. 2001, 7: хх-гг.
Google ученый
Гонен Т., Дональдсон П., Кистлер Дж.: Галектин-3 связан с плазматической мембраной клеток волокон хрусталика. Инвестировать. Офтальмол. Вис. науч. 2000, 41: 199-203.
Центральный пабмед КАС пабмед Google ученый
Barondes SH, Cooper DNW, Gitt MA, Leffler H: Галектины: Структура и функция большого семейства животных лектинов.
 Дж. Биол. хим. 1994, 269: 20807-20810.
Дж. Биол. хим. 1994, 269: 20807-20810.КАС пабмед Google ученый
Kaltner H, Steierstrofer B: Лектины животных как молекулы клеточной адгезии. Акта Анат. 1998, 161: 162-179. 10.1159/000046456.
КАС Статья пабмед Google ученый
Perillo NL, Marcus ME, Baum LG: галектины: универсальные модуляторы клеточной адгезии, клеточной пролиферации и гибели клеток. Дж. Мол. Мед. 1998, 76: 402-412. 10.1007/s0010
232.КАС Статья пабмед Google ученый
Liu FT, Hsu DK, Zuberi RI, Hill PN, Shenhav A, Kuwabara I, Chen SS: Модуляция функциональных свойств галектина-3 моноклональными антителами, связывающимися с нелектиновыми доменами. Биохим. 1996, 35: 6073-6079. 10.1021/bi952716q.
КАС Статья Google ученый
«>Jarvis LJ, Louis CF: Очистка и олигомерное состояние основных белков клеточной мембраны волокон хрусталика. Курс. Глаз Res. 1995, 14: 799-808.
КАС Статья пабмед Google ученый
Иванович В., Иглесиас М.М., Саймес Г.Д., Вольфенштейн-Тодель С.: Очистка и частичная характеристика галектина из овечьей плаценты. В кн.: Лектины: биология, биохимия, клиническая биохимия. (Под редакцией Van Driessche E, Rough P, Beeckmans S, Bog-Hansen TC) Textop, Hellerup, Дания. 1996, 11: 173-178.
Google ученый
«>Hughes RC: Секреция семейства галектинов белков, связывающих углеводы млекопитающих. Биохим. Биофиз. Акта. 1999, 1473: 172-185. 10.1016/С0304-4165(99)00177-4.
КАС Статья пабмед Google ученый
Aerts T, Xia JZ, Slegers H, de Block J, Clauwaert J: Гидродинамическая характеристика основного внутреннего белка мембран бычьего хрусталика. Дж. Биол. хим. 1990, 265: 8675-8680.
КАС пабмед Google ученый
Кониг Н., Зампиги Г.А., Джонатан П., Батлер Дж.Г.: Характеристика основного внутреннего белка (MIP) мембран волокон хрусталика крупного рогатого скота с помощью электронной микроскопии и гидродинамики.
 Дж. Мол. биол. 1997, 265: 590-602. 10.1006/jmbi.1996.0763.
Дж. Мол. биол. 1997, 265: 590-602. 10.1006/jmbi.1996.0763.КАС Статья пабмед Google ученый
Hasler L, Walz T, Tittmann P, Gross H, Kistler J, Engel A: Очищенный главный внутренний белок хрусталика (MIP) образует высокоупорядоченные тетрагональные двумерные массивы путем восстановления. Дж. Мол. биол. 1998, 279: 855-864. 10.1006/jmbi.1998.1796.
КАС Статья пабмед Google ученый
Jr Steele EC, Kerscher S, Lyon MF, Glenister PH, Favor J, Wang J, Church RL: Идентификация мутации в гене MP19, Lim 2 , у мутанта To3 мыши с катарактой. Мол. Вис. 1997, 3: 5-14.
Google ученый
Кистлер Дж., Голди К., Дональдсон П., Энгель А.: Восстановление щелевого соединения нехрусталиковых волокон нативного типа из изолированных полуканалов. Дж. Клеточная биология. 1994, 126: 1047-1058.
КАС Статья пабмед Google ученый
Massa SM, Cooper DNW, Leffler H, Barondes SH: L-29, эндогенный лектин, связывается с гликоконъюгатными лигандами с положительной кооперативностью. Биохим. 1993, 32: 260-267.
КАС Статья Google ученый
Ссылки на скачивание
Благодарности
Авторы благодарят доктора Чарльза Луи (Университет Миннесоты, Сент-Пол, США) за щедрый дар антитела против MP20. Это исследование было поддержано Советом по исследованиям в области здравоохранения Новой Зеландии, Советом по лотерейным грантам Новой Зеландии, Исследовательским комитетом Оклендского университета и докторской стипендией Оклендского университета (TG).
Информация об авторе
Авторы и организации
Школа биологических наук Оклендского университета, Окленд, Новая Зеландия
Тамир Гонен и Йорг Кистлер
Дисциплина физиологии, Школа медицинских и медицинских наук Оклендского университета, Окленд, Новая Зеландия
Ангус Кистлер Грей, Марк Д.
 Джейкобс и Пол Дж. Дональдсон
Джейкобс и Пол Дж. Дональдсон
Авторы
- Тамир Гонен
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Angus C Gray
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Marc D Jacobs
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Paul J Donaldson
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Йорг Кистлер
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Йорг Кистлер.
Оригинальные файлы изображений, представленные авторами
Ниже приведены ссылки на оригинальные файлы изображений, представленные авторами.
Авторский файл рисунка 1
Авторский файл рисунка 2
Оригинальный файл авторов для рисунка 3
Оригинальный файл авторов для рисунка 4
Оригинальный файл авторов для рисунка 5
Права и разрешения
Reprints и Permissions
Облизости
.
QED PurgeScan — MP20 — Отбор проб подземных вод
QED PurgeScan — MP20 — Отбор проб подземных вод — Продувка …- Панировочные сухари для дома
- Компании
- Экологические системы QED, Inc.

- Товары
- QED PurgeScan — модель MP20 — проточная кювета для стабилизации продувки
Отбор проб подземных вод
0
Делиться Поделиться с Facebook Поделиться в Твиттере Поделиться с LinkedIn
Технология QED PurgeScan обеспечивает более простую и точную стабилизацию продувки. Успешный, последовательный отбор проб подземных вод с низким расходом основан на знании того, когда параметры индикатора продувочной воды стабилизируются. Это гарантирует, что отбор проб начинается только тогда, когда пробы действительно репрезентативны для воды в окружающем водоносном горизонте.
Успешный, последовательный отбор проб подземных вод с низким расходом основан на знании того, когда параметры индикатора продувочной воды стабилизируются. Это гарантирует, что отбор проб начинается только тогда, когда пробы действительно репрезентативны для воды в окружающем водоносном горизонте.
До сих пор было сложно решить, когда была достигнута стабилизация; требовалось одновременно отслеживать несколько параметров качества подземных вод и проводить повторные расчеты, чтобы определить, находятся ли колебания каждого параметра в допустимых пределах. Проточная кювета MP20 навсегда изменила этот процесс. Микропроцессорная технология PurgeScan™ автоматически выполняет мониторинг и расчеты, четко сигнализируя о стабилизации с помощью звуковых и визуальных предупреждений.
Это делает отбор проб с малым расходом проще, точнее и эффективнее, поскольку освобождает время для выполнения других задач по отбору проб во время продувки. Вы можете сделать это правильно, собрав самые точные образцы и сэкономив время и деньги.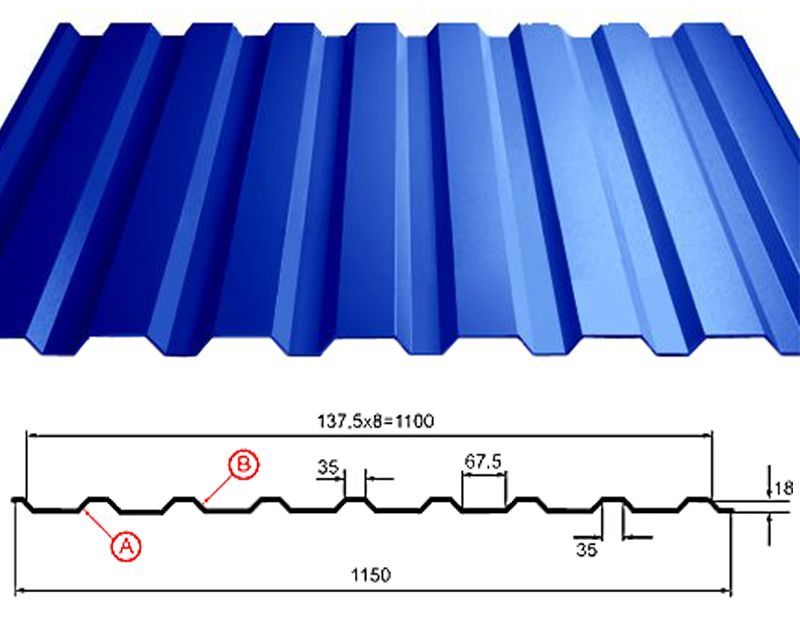
Помимо эксклюзивной функции PurgeScan, проточная ячейка MP20 была разработана для непрерывного мониторинга параметров качества подземных вод, таких как pH, температура, окислительно-восстановительный потенциал, электропроводность и мутность (дополнительный датчик) во время продувки.
Монитор качества проточной кюветы MicroPurge MP20 лидирует в области производительности, удобства, полноты и гарантии. Вдобавок ко всему, эксклюзивная технология QED PurgeScan автоматически сигнализирует о достижении стабилизации выбранных параметров качества воды и сохраняет ключевые точки данных.
- Эксклюзивная технология PurgeScan™ (патент США № 6,415,659) автоматически дает разрешение на отбор проб, когда выбранные параметры качества продувочной воды остаются стабильными при последовательных измерениях с заданными пользователем интервалами.
- Водонепроницаемый прибор MP20 (номер патента США 6 415 659) автоматически отображает все показания: pH, ОВП, температуру, проводимость, растворенный кислород и мутность (дополнительно).

- Эксклюзивный рН-электрод с длительным сроком службы значительно снижает затраты на техническое обслуживание
- Известен своей исключительной простотой калибровки
- Возможность быстрой загрузки на ПК и автоматическая отметка даты/времени (только для моделей MP20D и MP20DT)
- Прочный водонепроницаемый корпус можно использовать как рабочее место для измерений и калибровки.
- Прозрачная формованная проточная кювета эффективно удаляет пузырьки даже в горизонтальном положении; малый внутренний объем (175 мл), продуманное распределение потока и встроенная мешалка обеспечивают быструю реакцию на изменения качества продувочной воды даже при низкой скорости продувки.
- Эксклюзивная трехлетняя гарантия.
Проточная ячейка MicroPurge MP20 (номер патента США 6 415 659) отличается простотой использования и надежностью в традициях оборудования для отбора проб QED, разработанного для практических полевых условий. Легкий, водонепроницаемый измеритель MP20 высоко ценится за простоту калибровки. Он автоматически отображает все показания. Зонд представляет собой компактную низкопрофильную конструкцию с прочными и простыми в обслуживании датчиками. Проточная ячейка предназначена для эффективного сбора и выпуска пузырьков газа, а также для равномерного распределения продувочного потока для быстрого отклика измерения и получения более точных показаний. Вся система размещена в прочном водонепроницаемом корпусе, который можно использовать в качестве рабочего места для измерений и калибровки в полевых условиях.
Легкий, водонепроницаемый измеритель MP20 высоко ценится за простоту калибровки. Он автоматически отображает все показания. Зонд представляет собой компактную низкопрофильную конструкцию с прочными и простыми в обслуживании датчиками. Проточная ячейка предназначена для эффективного сбора и выпуска пузырьков газа, а также для равномерного распределения продувочного потока для быстрого отклика измерения и получения более точных показаний. Вся система размещена в прочном водонепроницаемом корпусе, который можно использовать в качестве рабочего места для измерений и калибровки в полевых условиях.
Весь комплект защищен эксклюзивной 3-летней гарантией, а также обслуживанием и поддержкой со стороны QED, лидера в области отбора проб с низким расходом.
Эксклюзивный оптимизированный путь потока, контактирующий с жидкостью
Проточная ячейка MP20 спроектирована таким образом, чтобы сенсорные датчики быстро и точно реагировали на изменения параметров продувочной воды. Проточная кювета на 100 % прозрачна для удобства наблюдения.


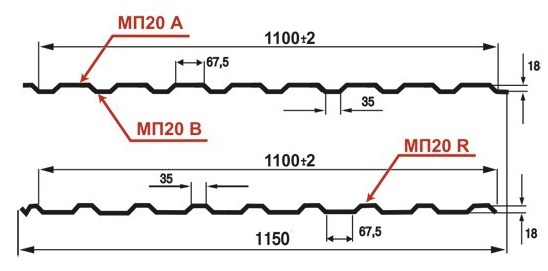
 Используется в основном в промашленном строительстве.
Используется в основном в промашленном строительстве. 

 в списке «Ритмические паттерны» на стр. 43 в руководстве).
в списке «Ритмические паттерны» на стр. 43 в руководстве).
 -Нажмите кнопки [Select] для выбора параметра «VOL:X» (диапазон = 1~9).-Используя кнопки [+Next] и/или [Prev-] для выбора уровня громкости.
-Нажмите кнопки [Select] для выбора параметра «VOL:X» (диапазон = 1~9).-Используя кнопки [+Next] и/или [Prev-] для выбора уровня громкости.
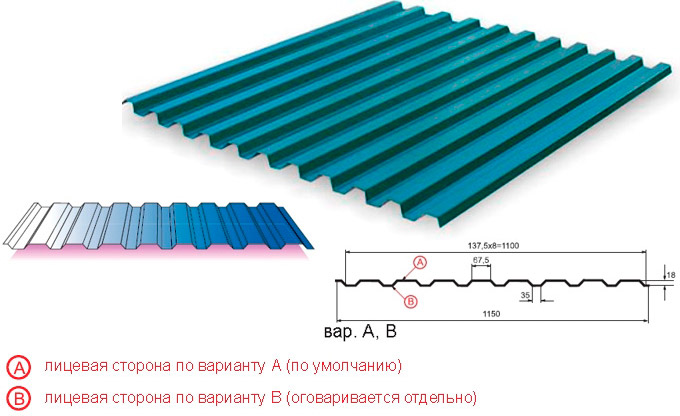

 Если вы сохранили разделенный или наложенный звук в Избранное, вы можете выбрать один из них.
Если вы сохранили разделенный или наложенный звук в Избранное, вы можете выбрать один из них.
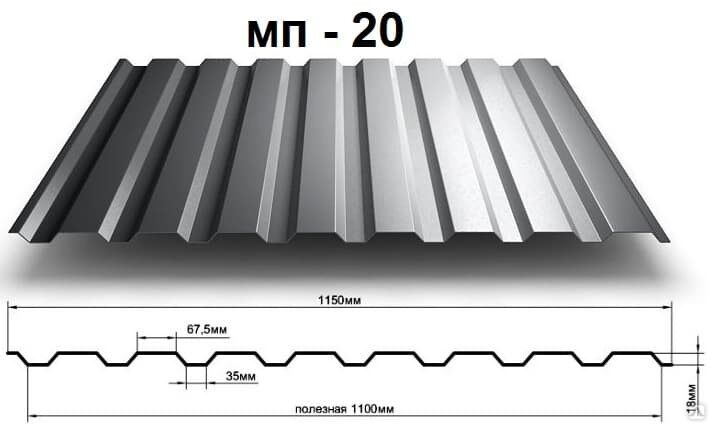 (значение по умолчанию для параметра METRO – OFF – если установлено OFF, метроном не будет запускаться).
(значение по умолчанию для параметра METRO – OFF – если установлено OFF, метроном не будет запускаться).
 ФЭБС лат. 1991, 288: 1-4. 10.1016/0014-5793(91)80988-Ф.
ФЭБС лат. 1991, 288: 1-4. 10.1016/0014-5793(91)80988-Ф. Дж. Клеточная биология. 1995, 129: 1691-1705.
Дж. Клеточная биология. 1995, 129: 1691-1705.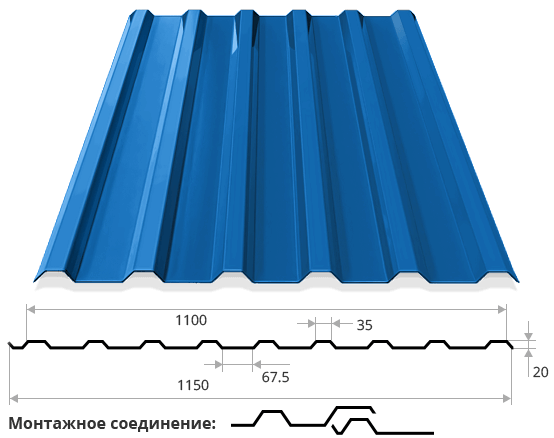 cdd.4400232.
cdd.4400232. Мол. биол. Клетка. 1999, 10: 2441-2459.
Мол. биол. Клетка. 1999, 10: 2441-2459. Глаз Res. 1993, 56: 35-43. 10.1006/упр.1993.1006.
Глаз Res. 1993, 56: 35-43. 10.1006/упр.1993.1006.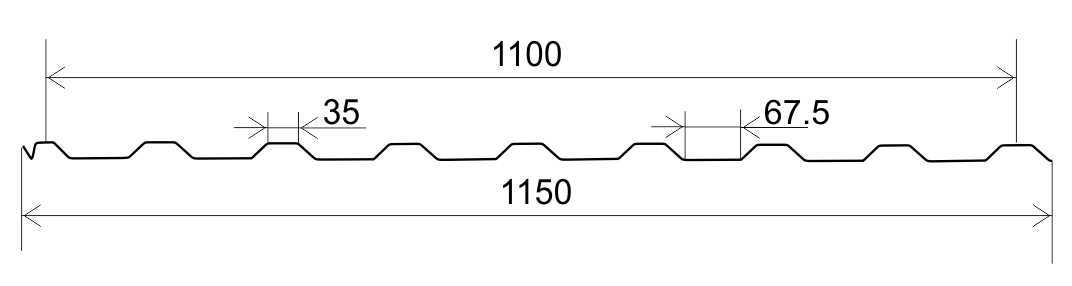 Дж. Биол. хим. 1994, 269: 20807-20810.
Дж. Биол. хим. 1994, 269: 20807-20810. Дж. Мол. биол. 1997, 265: 590-602. 10.1006/jmbi.1996.0763.
Дж. Мол. биол. 1997, 265: 590-602. 10.1006/jmbi.1996.0763.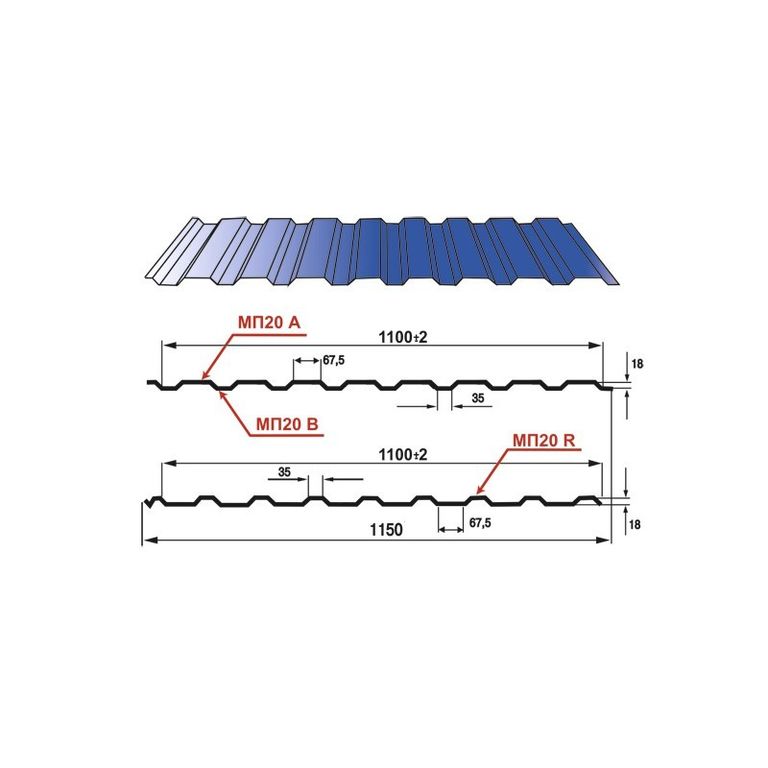 Джейкобс и Пол Дж. Дональдсон
Джейкобс и Пол Дж. Дональдсон